题目内容
下列叙述中正确的是
| A.pH相同的CH3COONa溶液、C6H5ONa溶液、Na2CO3溶液、NaOH溶液: c(CH3COONa)>c(C6H5ONa )>c(Na2CO3)>c(NaOH ) |
| B.将pH = 3的一元弱酸HA和pH = 11的NaOH溶液混合后溶液显碱性,一定有: c(H+) < c(OH- )< c(A-) <c(Na+) |
| C.在常温下,10 mL 0.02 mol·L-1 HCl溶液与10 mL 0.02 mol·L-1 Ba(OH)2溶液充分混合,体积为20 mL,则溶液的pH = 12+lg2 |
| D.将0.2 mol·L-1的盐酸与0.1 mol·L-1的NaAlO2溶液等体积混合,其溶液中离子浓度由小到大的顺序为:c(OH-)<c(Al3+)<c(H+)<c(Na+)<c(Cl-) |
A
酸越弱,相应的钠盐越容易水解,酸性是醋酸>碳酸>苯酚>碳酸氢钠,所以碳酸钠的水解程度最大,碱性最强。由于氢氧化钠是强碱,因此在pH相同的条件下,氢氧化钠的浓度最小,所以选项A正确。B中HA如果是强酸,则氢氧化钠过量,溶液才能显碱性。但如果HA是弱酸,则要使溶液显碱性,则氢氧化钠也是过量的,所以c(OH- )就可以大于c(A-) 的,B不正确。
C中碱过量,所以反应后的溶液中c(OH- )=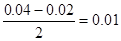 mol/L,所以pH=12,C不正确。
mol/L,所以pH=12,C不正确。
D中生成物是氢氧化铝、氯化铝和氯化钠,所以c(Al3+)>c(H+),D不正确。答案选A。
C中碱过量,所以反应后的溶液中c(OH- )=
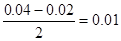 mol/L,所以pH=12,C不正确。
mol/L,所以pH=12,C不正确。D中生成物是氢氧化铝、氯化铝和氯化钠,所以c(Al3+)>c(H+),D不正确。答案选A。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 溶液的
溶液的 ,则该溶液中
,则该溶液中
 溶液与
溶液与 溶液反应至中性的离子方程式为:
溶液反应至中性的离子方程式为: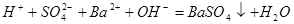
 ;②
;② ;③
;③ ;④
;④ ,四种溶液中
,四种溶液中 比较:②
比较:② ①
① 的溶液:
的溶液: 、
、 、
、 、
、 可以常量共存
可以常量共存
