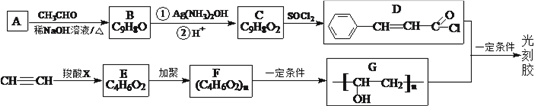
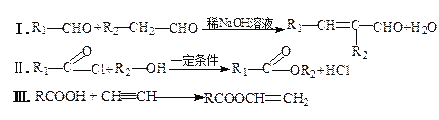题目内容
【题目】下列属于碱性氧化物的是
A.SiO2B.NaOHC.MgOD.K2CO3
【答案】C
【解析】
A. SiO2是酸性氧化物,与碱反应产生盐和水,A不符合题意;
B.NaOH电离产生的阴离子全部是碱,不属于碱性氧化物,B不符合题意;
C.MgO与酸反应产生盐和水,属于碱性氧化物,C符合题意;
D.K2CO3由金属阳离子和酸根离子组成,属于盐,D不符合题意;
故合理选项是C。

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
【题目】环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_________层(填"上"或"下"),分液后再用_________洗涤(填入编号)。已知:
密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
环己醇 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 0.81 | -103 | 83 | 难溶于水 |
A.KMnO4溶液 B.稀H2SO4 C. Na2CO3溶液