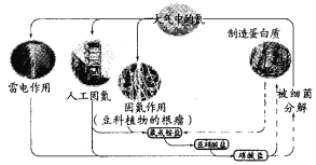
��Ŀ����
����Ŀ����ѧ�һ���̽���¼�����CO2�����ۺ����á�
��CO2�������ϳɵ�̼ϩ����2CO2(g)+6H2(g)![]() CH2=CH2(g)+4H2O(g) ��H=akJ/mol
CH2=CH2(g)+4H2O(g) ��H=akJ/mol
��ش�
��1����֪��H2��CH2=CH��ȼ���ȷֱ���285.8kJ/mol��1411.0kJ/mol����H2O(g)![]() H2O(��1����H=-44.0kJ/mol����a=________kJ/mol��
H2O(��1����H=-44.0kJ/mol����a=________kJ/mol��
��2��������CO2�ϳ�CH2=CH2�ķ�Ӧ��________���Է�����(����¡����¡�)��
��3�������Ϊ1L�ĺ����ܱ������У�����3molH2��1molCO2������¶ȶ�CO2��ƽ��ת���ʺʹ�����Ч�ʵ�Ӱ����ͼ1��ʾ������˵����ȷ����________��
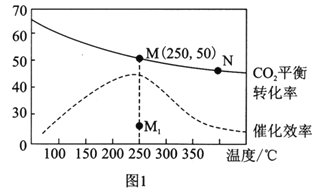
A��ƽ�ⳣ����С��KMN
B��������������,����ʹ�ô�������250��ʱCO2��ƽ��ת���ʿ���λ�ڵ�M1
C��ͼ1��M��ʱ,��ϩ���������Ϊ7.7%
D����ѹǿ��n(H2)/n(CO2)����ʱ����֤����ѧ��Ӧ�Ѵﵽƽ��״̬
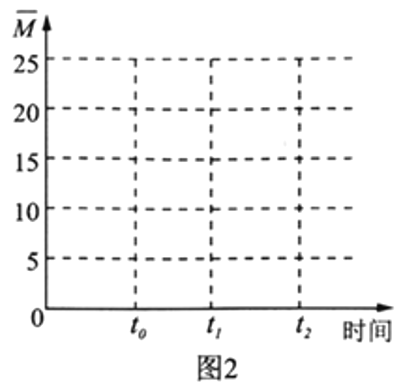
��4�������¶Ȳ���,�����ΪV L�ĺ�����������n(H2)��n(CO2)=3��1��Ͷ�ϱȼ��뷴Ӧ��,t0ʱ�ﵽ��ѧƽ�⡣����ͼ2�����������ڻ�������ƽ����Է�������![]() ��ʱ��仯��ͼ��___________
��ʱ��仯��ͼ��___________
�����á�Na-CO2����ؽ�CO2���Ϊ�����ҹ�������Ա���Ƴ��Ŀɳ�硰Na-CO2�����,���Ʋ��Ͷ��̼����(MWCNT)Ϊ�缫����,�ܷ�ӦΪ4Na+3CO2![]() 2Na2CO3+C���ŵ�ʱ�õ�ء����롱CO2,�乤��ԭ����ͼ3��ʾ��
2Na2CO3+C���ŵ�ʱ�õ�ء����롱CO2,�乤��ԭ����ͼ3��ʾ��
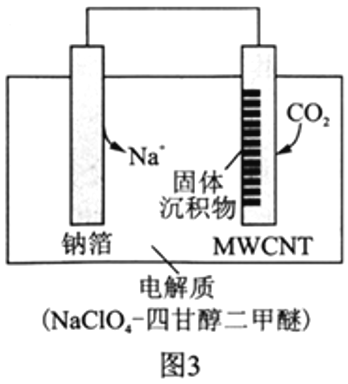
��5���ŵ�ʱ,�����ĵ缫��ӦʽΪ__________________��
��6�������ɵ�Na2CO3��Cȫ���������������棬��ת��0.2mole-ʱ���������ӵ�����Ϊ_______g��
��7��ѡ�ø��������ĸʴ������������Һ���ŵ���_____________________��
���𰸡� -127.8 ���� C  ����ͼҪ��O������(0,12.5)��t0ƽ��ʱ
����ͼҪ��O������(0,12.5)��t0ƽ��ʱ![]() ��12.5��20֮�䡣�� 3CO2+4Na++4e-=2Na2CO3+C 11.2 �����Ժá�������Ʋ���Ӧ���ѻӷ����ص�
��12.5��20֮�䡣�� 3CO2+4Na++4e-=2Na2CO3+C 11.2 �����Ժá�������Ʋ���Ӧ���ѻӷ����ص�
��������I.(1). �� H2(g)+1/2O2(g)=H2O(l) ��H=285.8kJ/mol��
�� C2H4(g)+3O2(g)=2H2O(l)+2CO2(g) ��H=1411.0kJ/mol��
�� H2O(g)�TH2O(l) ��H=44kJ/mol
���ݸ�˹���ɣ�6���٢�4���۵�2CO2(g)+6H2(g)![]() CH2=CH2(g)+4H2O(g) ��H=6��(285.8kJ/mol)(1411.0kJ/mol)4��(44kJ/mol)= 127.8kJ/mol���ʴ�Ϊ��127.8��
CH2=CH2(g)+4H2O(g) ��H=6��(285.8kJ/mol)(1411.0kJ/mol)4��(44kJ/mol)= 127.8kJ/mol���ʴ�Ϊ��127.8��
(2). �������������Ȼ�ѧ����ʽ��֪����H<0������Ϊ���ȷ�Ӧ��2CO2(g)+6H2(g)![]() CH2=CH2(g)+4H2O(g)��Ӧǰ�����������С���ر��S<0��Ҫ�����HT��S<0��Ӧ�ڵ��������Է����У��ʴ�Ϊ�����£�
CH2=CH2(g)+4H2O(g)��Ӧǰ�����������С���ر��S<0��Ҫ�����HT��S<0��Ӧ�ڵ��������Է����У��ʴ�Ϊ�����£�
(3). A. �����¶ȶ�����̼��ƽ��ת���ʽ��ͣ�������ƽ�������ƶ�������M�㻯ѧƽ�ⳣ������N�㣬��A����B. ��������ʹƽ�ⷢ���ƶ�����ͼ���֪�������������䣬����ʹ�ô�������250��ʱCO2��ƽ��ת����λ�ڵ�M����B����C. �����Ϊ1L�ĺ����ܱ������У�����3mollH2��1molCO2��ͼ��M��ʱ������̼ת����Ϊ50%��
6H2(g)+2CO2(g) ![]() CH2=CH2 (g)+4H2O(g)
CH2=CH2 (g)+4H2O(g)
��ʼ��(mol) 3 1 0 0
�仯��(mol) 1.5 0.5 0.25 1
ƽ����(mol) 1.5 0.5 0.25 1
����CH2=CH2���������=![]() ��100%=7.7%����C��ȷ��D���ɷ���ʽ��֪����ѹǿ����ʱ��˵����Ӧ�ﵽ��ƽ��״̬����H2��CO2����ʼ���������ڻ�ѧ������֮�ȣ���Ӧ������n( H2)/n(CO2 )ʼ�ղ���������n( H2)/n(CO2 )���䲻��֤����ѧ��Ӧ�Ѵﵽƽ��״̬����D����ѡC��
��100%=7.7%����C��ȷ��D���ɷ���ʽ��֪����ѹǿ����ʱ��˵����Ӧ�ﵽ��ƽ��״̬����H2��CO2����ʼ���������ڻ�ѧ������֮�ȣ���Ӧ������n( H2)/n(CO2 )ʼ�ղ���������n( H2)/n(CO2 )���䲻��֤����ѧ��Ӧ�Ѵﵽƽ��״̬����D����ѡC��
(4).��Ӧǰ��������ƽ����Է�������=![]() =12.5�������������Ϊ(0��12.5)�����ŷ�Ӧ��������������ʵ�����С����������ƽ����Է���������������t0ʱ�ﵽ��ѧƽ������ȫ��ת��ΪCH2=CH2��H2Oƽ����Է�������=
=12.5�������������Ϊ(0��12.5)�����ŷ�Ӧ��������������ʵ�����С����������ƽ����Է���������������t0ʱ�ﵽ��ѧƽ������ȫ��ת��ΪCH2=CH2��H2Oƽ����Է�������=![]() =20����t0��ƽ��ʱ
=20����t0��ƽ��ʱ![]() Ӧ������12.5��20֮��������ͼ��Ϊ
Ӧ������12.5��20֮��������ͼ��Ϊ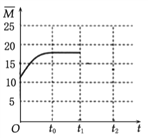 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
II. (5).�������ϣ�CO2�õ��ӷ�����ԭ��Ӧ���ʵ缫����ʽΪ3CO2+4Na++4e-=2Na2CO3+C���ʴ�Ϊ��3CO2+4Na++4e-=2Na2CO3+C��
(6).�����������ĵ缫��Ӧ��3CO2+4Na++4e-=2Na2CO3+C
3 4 2 1
0.15 0.2 0.1 0.05
m(��)=m(Na2CO3)+m(C)=106g/mol��0.1mol+12g/mol��0.05mol=11.2g���ʴ�Ϊ��11.2��
(7).ѡ���{�������ĸʴ������������Һ���ŵ��ǵ����Ժã�������Ʋ���Ӧ���ѻӷ��ȣ��ʴ�Ϊ�������Ժá�������Ʋ���Ӧ���ѻӷ����е���

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ���±���Ԫ�����ڱ���һ���֣���Ա��е���������Ԫ�أ���Ԫ�ط��Ż�ѧʽ��ջش��������⣺
���� | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
�� | �� | �� | ||||||
�� | �� | �� | �� | �� | �� | �� | ||
�� | �� | �� |
��1����������Ԫ���У�ԭ�Ӱ뾶������ �������ӵ�ԭ�ӽṹʾ��ͼΪ
��2��Ԫ�ص�����������Ӧ��ˮ������������ǿ�� ��������ǿ���� �������Ե����������� ��
��3����Ҫ��д�������������ʵĵ���ʽ�������⻯�� ���������������Ķ�Ӧ��ˮ���� ��
��4�����������ĵ����У���ѧ���ʽϻ��õ��� ������ʲô��ѧ��Ӧ˵������ʵ��д����Ӧ�Ļ�ѧ����ʽ���� ��