题目内容
(1)写出下列物质的电离方程式:
①CuCl2:
(2)我国是最早使用铜及其合金的国家之一,我国古代劳动人民更最早利用天然铜的化合物进行湿法炼铜,这是湿法技术的起源,是世界化学史上的一项发明.西汉《淮南子?万毕术》记载:曾青得铁则化为铜,曾青为硫酸铜.这种方法用现代化学式表示就是:Fe+CuSO4=FeSO4+Cu.在该反应中被氧化的元素是
①CuCl2:
CuCl2=Cu2++2Cl-
CuCl2=Cu2++2Cl-
②Ca (OH)2:Ca(OH)2=Ca2++2OH-
Ca(OH)2=Ca2++2OH-
(2)我国是最早使用铜及其合金的国家之一,我国古代劳动人民更最早利用天然铜的化合物进行湿法炼铜,这是湿法技术的起源,是世界化学史上的一项发明.西汉《淮南子?万毕术》记载:曾青得铁则化为铜,曾青为硫酸铜.这种方法用现代化学式表示就是:Fe+CuSO4=FeSO4+Cu.在该反应中被氧化的元素是
Fe
Fe
,氧化剂是CuSO4
CuSO4
;该反应的离子方程式为Fe+Cu2+═Fe2++Cu
Fe+Cu2+═Fe2++Cu
.分析:(1)氯化铜、氢氧化钙都是强电解质,完全电离,电离方程式用“=”;
(2)根据Fe+CuSO4=FeSO4+Cu中Cu元素的化合价降低、Fe元素的化合价升高来分析,离子方程式中铁、铜应保留化学式.
(2)根据Fe+CuSO4=FeSO4+Cu中Cu元素的化合价降低、Fe元素的化合价升高来分析,离子方程式中铁、铜应保留化学式.
解答:解:(1)①氯化铜是强电解质,完全电离,电离方程式为CuCl2=Cu2++2Cl-,故答案为:CuCl2=Cu2++2Cl-;
②氢氧化钙是强电解质,完全电离,电离方程式为Ca(OH)2=Ca2++2OH-,故答案为:Ca(OH)2=Ca2++2OH-;
(2)Fe+CuSO4=FeSO4+Cu中Cu元素的化合价降低,则CuSO4为氧化剂,Fe元素的化合价升高,作还原剂被氧化,则被氧化的元素为Fe,
离子反应为Fe+Cu2+═Fe2++Cu,故答案为:Fe;CuSO4;Fe+Cu2+═Fe2++Cu.
②氢氧化钙是强电解质,完全电离,电离方程式为Ca(OH)2=Ca2++2OH-,故答案为:Ca(OH)2=Ca2++2OH-;
(2)Fe+CuSO4=FeSO4+Cu中Cu元素的化合价降低,则CuSO4为氧化剂,Fe元素的化合价升高,作还原剂被氧化,则被氧化的元素为Fe,
离子反应为Fe+Cu2+═Fe2++Cu,故答案为:Fe;CuSO4;Fe+Cu2+═Fe2++Cu.
点评:本题考查电离方程式、离子方程式、氧化还原反应,明确电离方程式和离子方程式的写法及电荷守恒即可解答,并利用元素的化合价来分析氧化还原反应.

练习册系列答案
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案
相关题目
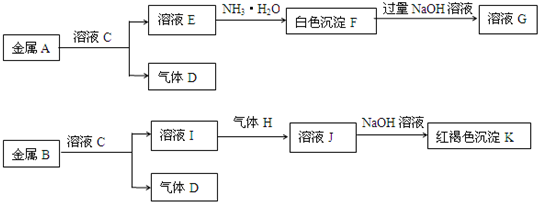
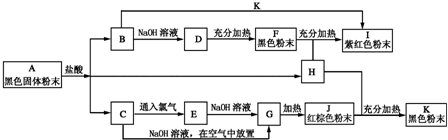
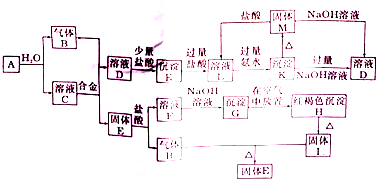
 如图是六种物质的相互转化关系.已知E是固态单质,常见于火山口处,六种物质中均含有构成E的元素.
如图是六种物质的相互转化关系.已知E是固态单质,常见于火山口处,六种物质中均含有构成E的元素.