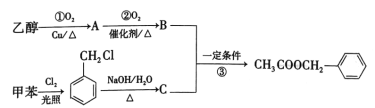
题目内容
【题目】H·C·Brown和Schlesinger于1942年在芝加哥大学发现的硼氢化钠(NaBH4)是最常用的还原剂之一,反应常生成偏硼酸钠(NaBO2)。有关实验流程如图所示:
![]()
I.氢化钠的制备:
已知NaH能在潮湿的空气中自燃。甲同学用如图所示装置(每种装置只选一次)来制取NaH。
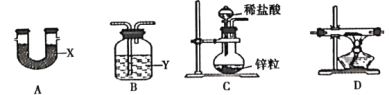
(1)装置的连接顺序是C→____________→D→__________,X、Y分别是__________、__________。
(2)通入H2,点燃装置D处酒精灯之前的实验操作是__________。若省略该操作,可能导致的后果是__________。
Ⅱ.硼氢化钠的制备及纯度测定:
将硼硅酸钠与氢化钠在450~500℃温度和(3.04~5.07)×105Pa压力下反应,生成硼氢化钠和硅酸钠。
(3)乙同学欲通过测定硼氢化钠与稀硫酸反应生成氢气的体积来确定硼氢化钠样品的纯度(杂质只有氢化钠),设计了以下4种装置,从易操作性、准确性角度考虑,宜选装置。__________

(4)称取4.04g样品(杂质只有氢化钠),重复实验操作三次,测得生成气体的平均体积为9.184L(已折算为标准状况),则样品中硼氢化钠的纯度为__________%(结果保留两位有效数字)。
Ⅲ.碉氢化钠的性质检验:
(5)碱性条件下,丙同学将NaBH4与CuSO4溶液反应可得到纳米铜和NaBO2,其离子方程式为__________。
【答案】A B 碱石灰(或生石灰等) 浓硫酸 验纯(或将装置中空气排尽) 爆炸(或仪器炸裂等) 丁 94 BH4-+4Cu2++8OH-=4Cu↓+BO2-+6H2O
【解析】
I.C装置由锌粒与稀盐酸反应制取氢气,制得的氢气中混有HCl和水蒸气,先通过碱性干燥剂除去水蒸气和氯化氢气体,经过处理的氢气再进入D与钠反应,反应之前先将氢气验纯,NaH易与水蒸气反应生成氢气,故D装置需要隔离水,所以还需要在D装置之后连接一个干燥装置,据此分析;
Ⅱ.(3)硼氢化钠与稀硫酸反应生成氢气的体积,首先要保证分液漏斗内液体顺利流下,量筒的精确度较低,量取气体的体积准确度不高,据此分析解答;
(4)设样品中NaH的物质的量为x,NaBH4的物质的量为y,则有24x+38y=4.04g,样品与稀硫酸反应,反应方程式为:2NaH+H2SO4=2H2↑+Na2SO4、2NaBH4+H2SO4+6H2O=8H2↑+2H3BO3+Na2SO4,生成气体的平均体积为9.184L,气体为氢气,故生成的n(H2)=![]() =0.41mol,有x+4y=0.41,解得x、y,可得其纯度;
=0.41mol,有x+4y=0.41,解得x、y,可得其纯度;
Ⅲ.(5)硼氢化钠是一种强还原剂,碱性条件下,NaBH4与CuSO4溶液发生氧化还原反应生成铜、NaBO2和水,据此书写离子反应方程式。
I.(1)根据分析,C装置中制取的氢气需要除杂和干燥,即除去水蒸气和氯化氢气体,应选择碱石灰(或生石灰等)既可以吸收氯化氢也可以吸收水分,D装置制得的NaH能在潮湿的空气中自燃,还需要在D装置之后连接一个干燥装置,则实验装置的连接顺序为C→A→D→B,A的盛装的试剂X为碱石灰(或生石灰等),B中盛装的试剂Y为浓硫酸;
(2)通入H2,点燃装置D处酒精灯之前的实验操作是验纯(或将装置中空气排尽);若省略该操作,氢气中混有空气,可能导致的后果是爆炸(或仪器炸裂等);
Ⅱ.(3)由于量筒的精确度不高,不属于精密的测量仪器,则收集的气体的体积准确度较低,硼氢化钠与稀硫酸反应时要确保反应装置内外压强相同,能使分液漏斗内的反应液顺利流下,综上分析应选择装置丁;
(4)设样品中NaH的物质的量为x,NaBH4的物质的量为y,则有24x+38y=4.04g,样品与稀硫酸反应,反应方程式为:2NaH+H2SO4=2H2↑+Na2SO4、2NaBH4+H2SO4+6H2O=8H2↑+2H3BO3+Na2SO4,生成气体的平均体积为9.184L,气体为氢气,故生成的n(H2)=![]() =0.41mol,有x+4y=0.41,解得y=0.1mol,x=0.01mol,则样品中硼氢化钠的纯度为
=0.41mol,有x+4y=0.41,解得y=0.1mol,x=0.01mol,则样品中硼氢化钠的纯度为![]() ×100%≈94%;
×100%≈94%;
Ⅲ.(5)硼氢化钠是一种强还原剂,碱性条件下,NaBH4与CuSO4溶液发生氧化还原反应生成铜、NaBO2和水,其离子方程式为BH4-+4Cu2++8OH-=4Cu↓+BO2-+6H2O。

 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案【题目】下列对一些实验事实和理论解释正确的是
选项 | 实验事实 | 理论解释 |
A | HCl气体溶于水,能导电 | HCl为离子化合物 |
B | HBr的酸性强于HCl的酸性 | Br的非金属性比Cl强 |
C |
|
|
D | HF的沸点高于HCl | F的非金属性比Cl强 |
A.AB.BC.CD.D