题目内容
CuCl2溶液中的铜主要以Cu (H2O)42+、CuCl42-形式存在,它们间有如下转化关系:Cu(H2O)42+(蓝色)+4Cl- CuCl42-(黄色)+4H2O;电解不同浓度的CuCl2溶液,均可看做Cu2+、Cl-直接放电。下图为电解浓度较大CuCl2溶液的装置,实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝。回答下列问题:
CuCl42-(黄色)+4H2O;电解不同浓度的CuCl2溶液,均可看做Cu2+、Cl-直接放电。下图为电解浓度较大CuCl2溶液的装置,实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝。回答下列问题:
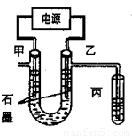
(1)甲电极的电极反应式为_________________。
(2)丙中溶液变蓝是乙电极产物与KI反应导致的,该反应的化学方程式为_________________。
(3)随电解的不断进行,U型管中溶液的颜色变化为__________;
A.由黄色变为浅蓝色??? B.由蓝色变为浅黄色
溶液颜色变化的原因是_________________。
(4)当电解到一定程度,甲电极附近出现蓝色Cu(OH) 2絮状物。经测,甲电极附近溶液的pH=a,此时甲电极附近溶液中c(Cu2+)=______ mol·L-1。(已知:Cu(OH) 2的Ksp=2.2×10-20)。
(5)电解较长时间后,丙中溶液的蓝色又会褪去,这是因为乙电极产物进一步将I2氧化为IO3-。该反应的离子方程式为______________。
(1)Cu2++2e-=Cu(2分)
(2)Cl2+2KI=2KCl+I2(2分)
(3)A(1分)? 随电解进行,Cl—不断消耗,CuCl42-转化为Cu(H2O)42+(2分)
(4)2.2×10(8-2a)(3分)
(5)5Cl2+I2+6H2O=10Cl-+2IO3-+12H+(3分)
【解析】
试题分析:(1)实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝,这说明乙电极产生氯气,即乙电极是阳极,所以甲电极是阴极,溶液中的铜离子放电,电极反应式为Cu2++2e-=Cu。
(2)氯气具有氧化性,能氧化碘化钾生成单质碘,碘遇淀粉显蓝色,所以反应的化学方程式为Cl2+2KI=2KCl+I2。
(3)由于随电解进行,Cl—不断消耗,使平衡Cu(H2O)42+(蓝色)+4Cl- CuCl42-(黄色)+4H2O 向逆反应方向移动,因此CuCl42-转化为Cu(H2O)42+,所以答案选A。
CuCl42-(黄色)+4H2O 向逆反应方向移动,因此CuCl42-转化为Cu(H2O)42+,所以答案选A。
(4)甲电极附近溶液的pH=a,则溶液中氢离子浓度是10-amol/L,则溶液中OH-浓度是10a-14mol/L,所以根据氢氧化铜的溶度积常数可知,溶液中铜离子浓度是 =2.2×10(8-2a)mol/L。
=2.2×10(8-2a)mol/L。
(5)氯气具有强氧化性,当碘化钾完全被氧化后,继续通入氯气可以把单质碘氧化生成碘酸盐,反应的离子方程式为5Cl2+I2+6H2O=10Cl-+2IO3-+12H+。
考点:考查电化学原理的应用、溶解平衡以及氧化还原反应方程式的书写等

 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案(10分)金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的。难溶金属的氢氧化物在不同pH下的溶解度(s,mol·L-1)见右图。
(1)pH=3时溶液中铜元素的主要存在形式是:________(化学式)
(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH为
A.<1 B.4左右 C.>6
(3)在Ni(NO3)2溶液中含有少量的Co2+杂质,___ (能、不能)通过调节溶液pH的方法来除去,理由是_________。
(4)已知一些难溶物的溶度积常数如下表。
| 物质 | FeS | MnS | CuS | PbS | HgS | ZnS |
| Ksp | 6.3×10-18 | 2.5×10-13 | 1.3×10-36 | 3.4×10-28 | 6.4×10-53 | 1.6×10-24 |
某工业废水中含有Cu2+、Pb2+、Hg2+,最适宜向此工业废水中加入过量的_______除去它们。
A.NaOH B.FeS C.Na2S
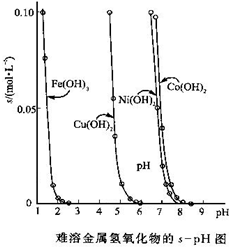 金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的.难溶金属的氢氧化物在不同pH下的溶解度(s,mol?L-1)见图.
金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的.难溶金属的氢氧化物在不同pH下的溶解度(s,mol?L-1)见图.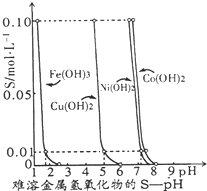 如图表示的是25℃时,难溶氢氧化物在不同pH下的溶解度(S/mol?L-1,假定该浓度为饱和溶液中阳离子的浓度).
如图表示的是25℃时,难溶氢氧化物在不同pH下的溶解度(S/mol?L-1,假定该浓度为饱和溶液中阳离子的浓度).