题目内容
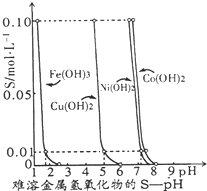 如图表示的是25℃时,难溶氢氧化物在不同pH下的溶解度(S/mol?L-1,假定该浓度为饱和溶液中阳离子的浓度).
如图表示的是25℃时,难溶氢氧化物在不同pH下的溶解度(S/mol?L-1,假定该浓度为饱和溶液中阳离子的浓度).请完成下列问题:
(1)pH=3时溶液中铜元素的主要存在形式是
Cu2+
Cu2+
.(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH
B
B
(填选项).A.<1 B.4左右 C.>6
(3)在Ni(NO3)2溶液中含有少量的Co2+杂质,
不能
不能
(填“能”或“不能”)通过调节溶液pH的方法来除去,理由是Co2+和Ni2+沉淀的pH范围相差太小
Co2+和Ni2+沉淀的pH范围相差太小
.(4)25℃下Ksp[Cu( OH )2]=
1.0×10-20
1.0×10-20
.(5)要使Cu(OH)2沉淀溶解,除了加酸之外,还可以加入氨水生成[Cu(NH3)4]2+,写出反应的离子方程式
Cu(OH)2+4NH3?H2O=[Cu(NH3)4]2++2OH-+4H2O
Cu(OH)2+4NH3?H2O=[Cu(NH3)4]2++2OH-+4H2O
.(6)已知一些难溶物的溶度积常数如下表.
| 物质 | FeS | MnS | CuS | PbS | HgS | ZnS |
| Ksp | 6.3×10-18 | 2.5×10-13 | 1.3×10-35 | 3.4×10-28 | 6.4×10-33 | 1.6×10-24 |
FeS
FeS
填选项B
B
. A.NaOH B.FeS C.Na2S.
分析:(1)由图可知,在pH=3时,溶液中不会出现Cu(OH)2沉淀;
(2)除去Fe3+的同时必须保证Cu2+不能沉淀,由图可知,因此pH应保持在4左右;
(3)Co2+和Ni2+沉淀的pH范围相差太小;
(4)由图可知,C(H+)=1×10-5mol?L-1,C(Cu2+)=1×10-2mol?L-1,根据KSP(Cu( OH )2)=C(Cu2+)×C2(OH-)来解答;
(5)根据反应物和生成物可写出反应的方程式;
(6)要使三种离子生成沉淀,最好选择难溶于水的FeS,使它们转化为更难溶解的金属硫化物沉淀,同时又不引入其它离子;
(2)除去Fe3+的同时必须保证Cu2+不能沉淀,由图可知,因此pH应保持在4左右;
(3)Co2+和Ni2+沉淀的pH范围相差太小;
(4)由图可知,C(H+)=1×10-5mol?L-1,C(Cu2+)=1×10-2mol?L-1,根据KSP(Cu( OH )2)=C(Cu2+)×C2(OH-)来解答;
(5)根据反应物和生成物可写出反应的方程式;
(6)要使三种离子生成沉淀,最好选择难溶于水的FeS,使它们转化为更难溶解的金属硫化物沉淀,同时又不引入其它离子;
解答:解:(1)由图可知,在pH=3时,溶液中不会出现Cu(OH)2沉淀,主要以Cu2+存在,故答案为:Cu2+;
(2)除去Fe3+的同时必须保证Cu2+不能沉淀,因此pH应保持在4左右Fe3+沉淀完全,故答案为:B;
(3)从图示关系可看出,Co2+和Ni2+沉淀的pH范围相差太小,无法控制溶液的pH,
故答案为:不能;Co2+和Ni2+沉淀的pH范围相差太小;
(4)由图可知,C(H+)=1×10-5mol?L-1,C(Cu2+)=1×10-2mol?L-1,
根据KSP(Cu( OH )2)=C(Cu2+)×C2(OH-)=1×10-2×(
)2=1.0×10-20,
故答案为:1.0×10-20;
(4)氢氧化铜沉淀溶于氨水生成=[Cu(NH3)4]2+,反应的离子方程式为Cu(OH)2+4NH3?H2O=[Cu(NH3)4]2++2OH-+4H2O,
故答案为:Cu(OH)2+4NH3?H2O=[Cu(NH3)4]2++2OH-+4H2O;
(5)要使三种离子生成沉淀,最好选择难溶于水的FeS,使它们转化为更难溶解的金属硫化物沉淀,同时又不引入其它离子.故答案为:B.
(2)除去Fe3+的同时必须保证Cu2+不能沉淀,因此pH应保持在4左右Fe3+沉淀完全,故答案为:B;
(3)从图示关系可看出,Co2+和Ni2+沉淀的pH范围相差太小,无法控制溶液的pH,
故答案为:不能;Co2+和Ni2+沉淀的pH范围相差太小;
(4)由图可知,C(H+)=1×10-5mol?L-1,C(Cu2+)=1×10-2mol?L-1,
根据KSP(Cu( OH )2)=C(Cu2+)×C2(OH-)=1×10-2×(
| 10 -14 |
| 1×10 -5 |
故答案为:1.0×10-20;
(4)氢氧化铜沉淀溶于氨水生成=[Cu(NH3)4]2+,反应的离子方程式为Cu(OH)2+4NH3?H2O=[Cu(NH3)4]2++2OH-+4H2O,
故答案为:Cu(OH)2+4NH3?H2O=[Cu(NH3)4]2++2OH-+4H2O;
(5)要使三种离子生成沉淀,最好选择难溶于水的FeS,使它们转化为更难溶解的金属硫化物沉淀,同时又不引入其它离子.故答案为:B.
点评:本题考查了沉淀溶解平衡及盐类水解的应用以及溶度积的计算,题目难度中等,解答本题的关键是认真审题,从图象曲线的变化特点把握物质的溶解性.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
下列图象表达正确的是( )
A、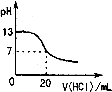 如图表示25℃时,用0.1 mol?L-1的盐酸滴定20 mL 0.1 mol?L-1的NaOH溶液 | B、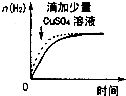 如图表示常温下,两份足量、等浓度的盐酸与等量锌粉反应时,其中一份滴加了少量硫酸铜溶液 | C、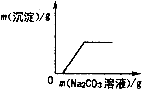 如图表示向CaCl2和盐酸的混合溶液中滴加Na2CO3溶液 | D、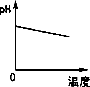 如图表示适当升高稀硫酸的温度 |
如图表示的是25℃时,难溶氢氧化物在不同pH下的溶解度.
请完成下列问题:
(1)pH=3时溶液中铜元素的主要存在形式是______.
(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH______(填选项).
A.<1 B.4左右 C.>6
(3)在Ni(NO3)2溶液中含有少量的Co2+杂质,______(填“能”或“不能”)通过调节溶液pH的方法来除去,理由是______.
(4)25℃下Ksp[Cu( OH )2]=______.
(5)要使Cu(OH)2沉淀溶解,除了加酸之外,还可以加入氨水生成[Cu(NH3)4]2+,写出反应的离子方程式______.
(6)已知一些难溶物的溶度积常数如下表.
为除去工业废水中含有的Cu2+、Pb2+、Hg2+杂质,最适宜向此工业废水中加入过量的______填选项______.
A.NaOH B.FeS C.Na2S.

请完成下列问题:
(1)pH=3时溶液中铜元素的主要存在形式是______.
(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH______(填选项).
A.<1 B.4左右 C.>6
(3)在Ni(NO3)2溶液中含有少量的Co2+杂质,______(填“能”或“不能”)通过调节溶液pH的方法来除去,理由是______.
(4)25℃下Ksp[Cu( OH )2]=______.
(5)要使Cu(OH)2沉淀溶解,除了加酸之外,还可以加入氨水生成[Cu(NH3)4]2+,写出反应的离子方程式______.
(6)已知一些难溶物的溶度积常数如下表.
| 物质 | FeS | MnS | CuS | PbS | HgS | ZnS |
| Ksp | 6.3×10-18 | 2.5×10-13 | 1.3×10-35 | 3.4×10-28 | 6.4×10-33 | 1.6×10-24 |
A.NaOH B.FeS C.Na2S.

 某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的酸度(酸度单位:g/100ml),现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:
某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的酸度(酸度单位:g/100ml),现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围: