题目内容
9.在盛有饱和碳酸钠溶液的烧杯中插入惰性电极,保持温度不变,通电一段时间后( )| A. | 溶液的pH将增大 | B. | 钠离子数和碳酸根离子数的比变小 | ||
| C. | 溶液浓度增大并有晶体析出 | D. | 溶液浓度不变,有晶体析出 |
分析 盛有饱和碳酸钠溶液的烧杯中插入惰性电极,保持温度不变,通电时氢离子放电生成氢气,氢氧根离子放电生成氧气,即电解水,结合饱和溶液溶剂减少来解答.
解答 解:盛有饱和碳酸钠溶液的烧杯中插入惰性电极,保持温度不变,通电时氢离子放电生成氢气,氢氧根离子放电生成氧气,即电解水,
A.因温度不变,溶剂减少后还是饱和溶液,则浓度不变,pH不变,故A错误;
B.因温度不变,溶剂减少后还是饱和溶液,则钠离子数和碳酸根离子数的比不变,故B错误;
C.因温度不变,溶剂减少后还是饱和溶液,则溶液浓度不变,故C错误;
D.原溶液为饱和溶液,温度不变,溶剂减少时有晶体析出,溶液仍为饱和溶液,浓度不变,故D正确;
故选D.
点评 本题考查电解及饱和溶液的浓度,注意电解水相当于饱和溶液的蒸发,明确温度不变,饱和溶液的浓度不变是解答本题的关键,题目难度中等.

练习册系列答案
相关题目
20.下列各组物质间的反应与反应类型不相符的是( )
| A. | 乙烯与溴水(加成反应) | |
| B. | 甲苯与浓硝酸(硝化反应) | |
| C. | 氯乙烷与氢氧化钠醇溶液 (取代反应) | |
| D. | 乙烯与高锰酸钾(氧化反应) |
4.下列混合溶液中,各离子浓度的大小顺序正确的是( )
| A. | 10mL0.1mol/L氨水与10mL0.1mol/L盐酸混合,c(Cl-)>c(NH${\;}_{4}^{+}$)>c(OH-)>c(H+) | |
| B. | 10mL0.1mol/L NH4Cl溶液与5mL0.2mol/LNaOH溶液混合,c(Na+)=c(Cl-)>c(OH-)>c(H+) | |
| C. | 10mL0.1mol/LCH3COOH溶液与5mL0.2mol/LNaOH溶液混合,c(Na+)=c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 10mL0.5mol/LCH3COONa溶液与6mL 1mol/L盐酸混合,c(Na+)=c(Cl-)>c(H+)>c(OH-) |
1.分类法在化学学科的发展中起到了非常重要的作用,下列分类标准不合理的是( )
| A. | 根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 | |
| B. | 根据反应中是否有电子转移,将化学反应分为氧化还原反应和非氧化还原反应 | |
| C. | 根据是否含氧元素,将物质分为氧化剂和还原剂 | |
| D. | 根据水溶液或熔融状态是否能够导电,将化合物分为电解质和非电解质 |
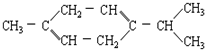 还可以简写为
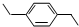
还可以简写为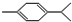 ,下列有机物中,与上述有机物互为同分异构体的是( )
,下列有机物中,与上述有机物互为同分异构体的是( )