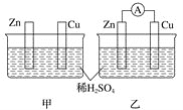
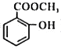
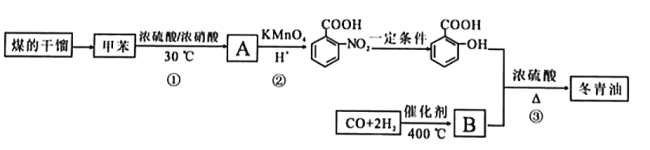
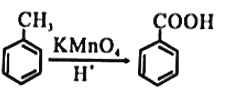题目内容
【题目】工业上可由水煤气合成甲醇。
(1)还可以通过下列反应制备甲醇:CO(g)+2H2(g)![]() CH3OH(g),下图是反应时CO(g)和CH3OH(g)的浓度随时间t的变化情况,从反应开始到平衡,用CO表示平均反应速率v(CO)=__________,该反应的平衡常数表达式为__。
CH3OH(g),下图是反应时CO(g)和CH3OH(g)的浓度随时间t的变化情况,从反应开始到平衡,用CO表示平均反应速率v(CO)=__________,该反应的平衡常数表达式为__。

(2)在一容积可变的密闭容器中充入10mol CO和20mol H2,CO的平衡转化率随温度(T)、压强(P)的变化如图所示。
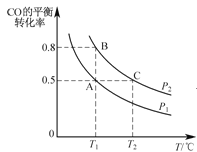
①下列说法不能判断该反应达到化学平衡状态的是_________。(填字母)
A.H2的消耗速率等于CH3OH的生成速率的2倍
B.H2的体积分数不再改变
C.体系中H2的转化率和CO的转化率相等
D.体系中气体的平均摩尔质量不再改变
②比较A、B两点压强大小PA_PB(填“>、<、=”).
③若达到化学平衡状态A时,容器的体积为20 L,如果反应开始时仍充入10 mol CO和20 mol H2,则在平衡状态B时容器的体积V(B)=__L。
【答案】0.075mol·L﹣1·min﹣1 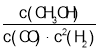 AC < 4
AC < 4
【解析】
(1)随反应进行,CO浓度减小、甲醇浓度增大,由图可知,10 min到达平衡,CO浓度变化为(0.9-0.15)mol/L=0.75mol/L,根据反应速率的定义求解即可;化学平衡常数是指:一定温度下,可逆反应到达平衡时,生成物的浓度系数次幂之积与反应物的浓度系数次幂之积的比,固体、纯液体不需要在化学平衡常数中写出;
(2)①可逆反应到达平衡时,同种物质的正逆速率相等,各组分的浓度、含量保持不变,由此衍生的其它一些量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不变化说明到达平衡;
②温度一定时,正反应为气体体积减小的反应,增大压强,平衡向正反应方向移动,CO的转化率增大;
③A、B温度相同,平衡常数相同,若达到化学平衡状态A时,容器的体积为20L,CO转化率为50%,则转化的CO为10mol×50%=5mol,依据三段式求出平衡常数,计算B状态时各组分物质的量,再结合平衡常数计算体积。
(1)随反应进行,CO浓度减小、甲醇浓度增大,由图可知,10min到达平衡,CO浓度变化为(0.90.15)mol/L=0.75mol/L,则v(CO)=![]() =0.075molL1min1;该反应的平衡常数表达式K=
=0.075molL1min1;该反应的平衡常数表达式K=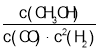 ,故答案为:0.075;
,故答案为:0.075;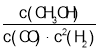 ;
;
(2)①A.H2的消耗速率等于CH3OH的生成速率的2倍,均表示正反应速率,反应始终按该比例关系进行,不能说明到达平衡,A项错误;
B.H2的体积分数不再改变是化学平衡的特征,达到了平衡,B项正确;
C. 氢气、CO的转化率与它们起始物质的量有关,平衡时不一定相等,若起始物质的量之比等于化学计算量之比,转化率始终相等,C项错误;
D. 混合气体总质量不变,随反应进行,混合气体总物质的量减小,平均摩尔质量增大,混合气体气体的平均摩尔质量不再改变,说明达到了平衡,D项正确;
故答案为:AC;
②温度一定时,正反应为气体体积减小的反应,增大压强,平衡向正反应方向移动,CO的转化率增大,故压强PA<PB,
故答案为:<;
③若达到化学平衡状态A时,容器的体积为20 L,CO转化率为50%,则转化的CO为10mol×50%=5mol,则:
CO(g)+2H2(g)═CH3OH(g)
起始量(mol):10 20 0
变化量(mol):5 10 5
平衡量(mol):5 10 5
平衡常数K=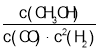 =
=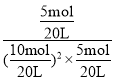 =4,
=4,
如果反应开始时仍充入10molCO和20molH2,在平衡状态B时CO转化率为80%,则转化的CO为10mol×80%=8mol,则:
CO(g)+2H2(g)═CH3OH(g)
起始量(mol): 10200
变化量(mol): 8168
平衡量(mol): 248
设体积为V L,则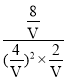 =4,解得V=4,
=4,解得V=4,
故答案为:4。

【题目】利用活性铁可以很好地消除酸性水体中![]() 造成的污染,除去原理如图所示。下列说法中正确的是
造成的污染,除去原理如图所示。下列说法中正确的是
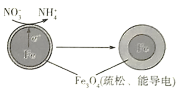
A.铁电极的电极反应式:![]()
B.![]() 在负极上发生还原反应
在负极上发生还原反应
C.除![]() 的过程中水体
的过程中水体![]() 减小
减小
D.当电路中有![]() 电子转移时,溶液中会有
电子转移时,溶液中会有![]() 生成
生成
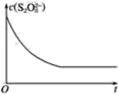
【题目】碘在科研与生活中有重要应用。某兴趣小组用0.2 %淀粉溶液、0.50 mol·L-1KI、0.20 mol·L-1K2S2O8、0.10 mol·L-1Na2S2O3等试剂,探究反应条件对化学反应速率的影响。已知:S2O82-+2I-=2SO42-+I2(慢) I2+2 S2O32-=2I-+S4O62-(快)
(1)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:
实验序号 | 体积V/mL | ||||
K2S2O8溶液 | 水 | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
10.0 | 0.0 | 4.0 | 4.0 | 2.0 | |
9.0 | 1.0 | 4.0 | 4.0 | 2.0 | |
8.0 | V8 | 4.0 | 4.0 | 2.0 | |
表示V8=________mL,理由是__________________。
(2)已知某条件下,浓度c(S2O82-)-反应时间t的变化曲线如图所示,若保持其他条件不变,请在坐标图中,分别画出降低反应温度和加入催化剂时c(S2O82-)-t的变化曲线示意图(进行相应的标注)。_________