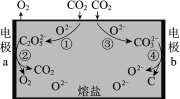
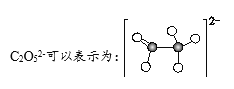
题目内容
【题目】对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施。
(1)含氰废水中的CN-有剧毒。
①CN-中N元素显-3价,用原子结构解释N元素显负价的原因是_______。
②NaClO溶液可将CN-氧化成N2、HCO3-,从而消除CN-污染,反应的离子方程式为_____。
(2)含乙酸钠和对氯酚(![]() )的废水可以利用微生物电池除去,其原理如图所示。
)的废水可以利用微生物电池除去,其原理如图所示。
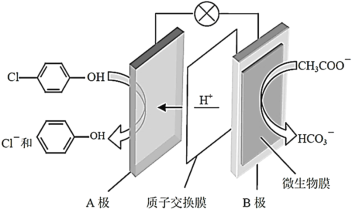
①A是电池的_________极(填“正”或“负”);
②B极的电极反应式为_______。
(3)含重金属铬(Ⅵ)的废水具有较强的毒性,离子交换树脂(ROH)法可将有毒废水中的CrO42-和Cr2O72-吸附至树脂上除去,原理如下:2ROH+CrO42-→R2CrO4+2OH-、2ROH+Cr2O72-→R2Cr2O7+2OH- (已知:废水中存在如下平衡:2CrO42-+2H+![]() Cr2O72-+H2O)。
Cr2O72-+H2O)。
控制溶液酸性可以提高树脂对铬(Ⅵ)的去除率,其理由是_________。
【答案】C原子与N原子间存在共用电子对,C和N的原子电子层数相同(同周期),核电荷数C<N,原子半径C>N,原子核对核外电子吸引能力C<N,共用电子对偏向N,N元素显负价 2CN-+5ClO-+H2O=HCO3-+N2↑+5Cl- 正 CH3COO--8e-+4H2O=2HCO3-+9H+ 由原理可知:2ROH~CrO42-~Cr,2ROH~Cr2O72-~2Cr,等量树脂去除Cr2O72-的效率高,因此控制酸性使上述平衡(2CrO42-+2H+![]() Cr2O72-+H2O)正向移动,使CrO42-转化为Cr2O72-
Cr2O72-+H2O)正向移动,使CrO42-转化为Cr2O72-
【解析】
(1)①根据元素非金属性强弱及对电子对吸引能力大小分析;
②根据电子守恒、电荷守恒、原子守恒分析、书写;
(2)①根据原电池中阳离子的移动方向确定正、负极;
②原电池中正极上得电子,发生还原反应;负极失去电子,发生氧化反应,结合B极反应物及生成物来分析解答;
(3)由原理可知:2ROH~CrO42-~Cr,2ROH~Cr2O72-~2Cr,等量树脂去除Cr2O72-的效率高。
(1)①C、N都是同一周期的非金属性元素,原子间以共用电子对,由于元素的核电荷数C<N,所以原子半径C>N,原子半径越小,吸引电子能力就越强,原子核对核外电子吸引能力C<N,因此共用电子对偏向N,而偏离C原子,从而使N元素显负价;
②NaClO具有强氧化性,可将CN-氧化成N2、HCO3-,ClO-被还原产生Cl-,从而消除CN-污染。根据电子守恒、电荷守恒、原子守恒,可得该反应的离子方程式为:2CN-+5ClO-+H2O=HCO3-+N2↑+5Cl-;
(2)①在原电池中H+的移动方向是从负极流向正极,根据示意图可知:H+向A电极移动,所以A电极为正极,B电极为负极;
②A是正极,B是负极,负极上CH3COO-失去电子,与溶液中的H2O结合产生HCO3-,同时得到H+,则负极B上发生的电极反应式为:CH3COO--8e-+4H2O=2HCO3-+9H+;
(3)由原理可知:2ROH~CrO42-~Cr,2ROH~Cr2O72-~2Cr,等量树脂去除Cr2O72-的效率高。由于在废水中存在平衡:2CrO42-+2H+![]() Cr2O72-+H2O,在其它条件不变时,增大c(H+),使溶液的酸性增强,化学平衡正向移动,使更多的CrO42-转化为Cr2O72-,从而提高了污水中Cr的去除率。
Cr2O72-+H2O,在其它条件不变时,增大c(H+),使溶液的酸性增强,化学平衡正向移动,使更多的CrO42-转化为Cr2O72-,从而提高了污水中Cr的去除率。

【题目】某化学研究性学习小组的同学根据理论分析后认为,NO2可能会氧化单质铜,他们设想利用下图所示装置验证NO2的氧化性(夹持装置已省略)。
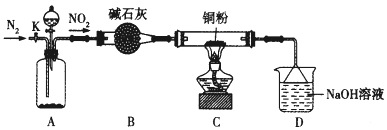
(1)装置A~C中有一处错误,改正的方法是_____________,A中发生反应的两种试剂通常是________。
(2)点燃C处酒精灯比较合适的时机是_____________。若C中固体全部变成黑色,同时生成对环境无污染的气体,写出C中反应的化学方程式:______________。装置D的用途是____________。
(3)开关K的设计是以实现绿色化学实验为目的,请说明K的使用方法______________。(包括使用时段与内容)。
(4)实验结束后发现C中的固体混有少量的红色粉末,经过分析,甲同学认为该红色粉末是Cu2O,乙同学认为该红色粉末是![]() ,丙同学认为该红色粉末是Cu和Cu2O的混合物。查阅资料,Cu、Cu2O和CuO的部分性质如下:
,丙同学认为该红色粉末是Cu和Cu2O的混合物。查阅资料,Cu、Cu2O和CuO的部分性质如下:
稀硫酸 | 氨水 | |
Cu2O | 生成Cu和Cu2+ | 生成无色[Cu(NH3)2]2+ |
CuO | 生成Cu2+ | 生成蓝色[Cu(NH3)4]2+ |
Cu | --- | --- |
请设计一个简单的实验证明甲同学的看法是否正确:________________。