题目内容
【题目】向50mL Na2SO4和Na2CO3的混合溶液中加入过量的BaCl2溶液,得到4.3 g白色沉淀,向白色沉淀中再加入过量的稀HCl,充分反应后,沉淀减少到2.33 g,并有气体产生。求:
(1)原混合物溶液中Na2SO4的物质的量浓度是多少?___________
(2)产生多少mol CO2?___________
【答案】c(Na2SO4)=0.2 mol/L n(CO2)=0.01 mol
【解析】
(1)根据题意发生反应:Na2SO4+BaCl2=BaSO4↓+2NaCl、BaCl2+Na2CO3=2NaCl+BaCO3↓、BaCO3+2HCl═BaCl2+H2O+CO2↑;4.3 g克白色沉淀是BaCO3和BaSO4混合物,BaSO4不溶于水与盐酸,BaCO3溶于盐酸,沉淀减少到2.33 g为BaSO4的质量,可得BaCO3的质量为4.3g-2.33g=1.97g,计算BaCO3和BaSO4的物质的量,Na2SO4的物质的量等同于BaSO4的物质的量,Na2CO3的物质的量等同于BaCO3的物质的量,再根据c=![]() ,计算原混和溶液中Na2CO3和Na2SO4的物质的量浓度;
,计算原混和溶液中Na2CO3和Na2SO4的物质的量浓度;
(2)由BaCO3+2HCl═BaCl2+H2O+CO2↑,可知n(CO2)=n(BaCO3),可以知道二氧化碳的物质的量。
(1)发生反应:Na2SO4+BaCl2=BaSO4↓+2NaCl、BaCl2+Na2CO3=2NaCl+BaCO3↓、BaCO3+2HCl═BaCl2+H2O+CO2↑; m(BaSO4)=2.33g,则m(BaCO3),4.3g2.33g=1.97g,
n(SO42)=n(BaSO4)=![]() =0.01mol, c(Na2SO4)=c(SO42)=
=0.01mol, c(Na2SO4)=c(SO42)=![]() =0.2mol/L;
=0.2mol/L;
(2) n(CO32)=n(BaCO3)=![]() =0.01mol,n(CO2)=n(BaCO3)=0.01mol,故n(CO2)=0.01 mol。
=0.01mol,n(CO2)=n(BaCO3)=0.01mol,故n(CO2)=0.01 mol。

【题目】中科院一项最新成果实现了甲烷高效生产乙烯,甲烷在催化作用下脱氢,在气相中经自由基偶联反应生成乙烯,其反应如下:2CH4(g)![]() C2H4(g) +2H2(g) △H >0
C2H4(g) +2H2(g) △H >0
化学键 | H—H | C—H | C = C | C—C |
E(kJ / mol) | a | b | c | d |
(1)已知相关化学键的键能如表,甲烷制备乙烯反应的△H =______(用含a.b.c.d的代数式表示)。
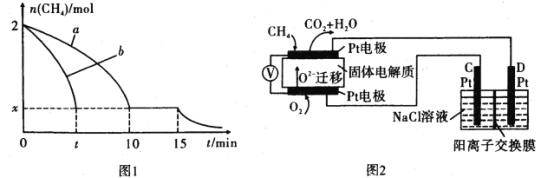
(2)T1温度时,向1L的恒容反应器中充入2 molCH4,仅发生上述反应,反应过程中0~15 min CH4的物质的量随时间变化如图1,测得10-15 min时H2的浓度为1.6molL-1
①0~10min内CH4表示的反应速率为____mol/(Lmin) o
②若图1中曲线a、曲线b分别表示在温度T1时,使用质量相同但表面积不同的催化剂时,达到平衡过程中n (CH4)的变化曲线,其中表示催化剂表面积较大的曲线是____(填“a”或 “b”)。
③15 min时,若改变外界反应条件,导致n( CH4)发生图中所示变化,则改变的条件可能是________(任答一条即可)。
(3)实验测得:v正=K正c2(CH4),v逆=K逆c(C2H4)c2(H2),其中K正、K逆为速率常数仅与温度有关,T1温度时k正与K逆的比值为____(填数值)。若将温度由T1升高到T2,则反应速率增大的倍数V正____V逆(选填“>”、“<”或“=”);判断的理由是__________
(4)科研人员设计了甲烷燃料电池并用于电解。如图2所示,电解质是掺杂了Y2O3与ZrO2的固体,可在高温下传导O2-
①C极的Pt为_____极(选填“阳”或“阴” )。
②该电池工作时负极反应方程式为_______。
③用该电池电解饱和食盐水,一段时间后收集到标况下气体总体积为112 mL,则电解后所得溶液在25℃时pH=_____(假设电解前后NaCl溶液的体积均为500 mL)。
【题目】结合下表回答下列问题(均为常温下的数据):
酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) |
CH3COOH | 1.8×10-5 | H2CO3 | K1=4.4×10-7 K2=4.7×10-11 | H2C2O 4 | K1=5.4×10-2 K2=5.4×10-5 | H2S | K1=1.3×10-7 K2=7.1×10-15 |
HClO | 3×10-8 |
请回答下列问题:
(1)同浓度的CH3COO-、HCO3-、CO32-、HC2O4-、ClO-、S2-中结合H+的能力最弱的是__________。
(2)常温下0.1 molL-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是_______(填序号)。
A.c(H+) B. c(H+)/c(CH3COOH) C. c(H+)/c(OH-) D. c(OH-)
(3)0.1 molL-1的H2C2O4溶液与0.1 molL-1的KOH的溶液等体积混合后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为______________。
(4)pH相同的NaClO和CH3COOK溶液,其溶液的物质的最浓度的大小关系是:CH3COONa______NaClO,两溶液中:[c(Na+)-c(ClO-)]______[c(K+)-c(CH3COO-)](填“>”“<”或“=”)。
(5)向0.1 molL-1CH3COOH 溶液中滴加 NaOH 溶液至 c(CH3COOH): c(CH3COO-)=5 : 9,此时溶液pH=_______________。