题目内容
在密闭容器中,反应X2(g)+Y2(g) 2XY(g) ΔH<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是( )
2XY(g) ΔH<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是( )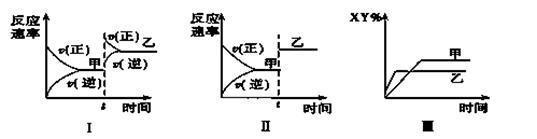
| A.图Ⅰ是增大压强的变化情况 |
| B.图Ⅱ是一定是加入催化剂的变化情况 |
| C.图Ⅲ是增大压强或升高温度的变化情况 |
| D.图Ⅲ一定是升高温度的变化情况 |
D
解析试题分析:A、因催化剂使正逆反应速率同等程度的增大,则与图Ⅰ不符合,错误;B、扩大容器体积相当于减小压强,则正逆反应速率同等程度的减小,而图象中反应速率同等程度的增大,与图Ⅱ不符合,错误;C、对该反应,改变压强化学平衡不移动,则XY的含量不发生变化,与图象Ⅲ不符合,错误;D、由图象可知乙的温度大于甲的温度,升高温度化学平衡逆向移动,XY的含量减小,与图象相符合,正确。
考点:本题考查化学反应速率、化学平衡与图象的关系,明确影响因素及图象中纵横坐标的含义、点与线的含义是解答本题的关键。

练习册系列答案
相关题目
下列条件:①增加反应物的物质的量 ②升高温度 ③缩小反应容器的体积 ④不断分离出生成物 ⑤加入MnO2,一定能使反应速率增大的是
| A.② | B.②③ | C.①②⑤ | D.全部 |
下列关于化学反应速率的说法正确的是( )
| A.根据化学反应速率的大小可以知道化学反应进行的快慢 |
| B.化学反应速率为0.8mol/(L·s)是指1s时某物质的浓度为0.8mol/L |
| C.化学反应速率是指一定时间内反应物的物质的量减少或生成物的物质的量增加 |
| D.对于任何化学反应来说,反应速率越大,反应现象就越明显 |
在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
| 物质 | X | Y | Z |
| 初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y
 2Z,其平衡常数值为1600
2Z,其平衡常数值为1600C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
下列各表述与示意图一致的是
A.图①表示N2O4(g) 2NO2(g) ΔH>0,N2O4转化率随温度、时间的变化 2NO2(g) ΔH>0,N2O4转化率随温度、时间的变化 |
B.图②中曲线表示反应2SO2(g)+O2(g) 2SO3(g) ΔH<0,正、逆反应的平衡常数K随温度的变化 2SO3(g) ΔH<0,正、逆反应的平衡常数K随温度的变化 |
| C.图③表示10 mL0.01 mol/LKMnO4酸性溶液与过量0.1mol/LH2C2O4溶液混合时,n(Mn2+)随时间的变化 |
| D.图④中a、b曲线分别表示反应CH2=CH2(g)+H2(g) |
一定条件下,Cu2+、Mn2+、Fe3+的浓度对乙酸在光照下催化降解速率的影响如图所示。下列判断错误的是
| A.该实验方案的缺陷之一是未做空白对照实验 |
| B.Cu2+、Mn2+提高乙酸降解速率的最佳浓度为0.1 mmol·L-l |
| C.Fe3+不能提高乙酸降解速率 |
| D.相同条件下,乙酸在Cu2+、Mn2+、Fe3+作用下的降解速率依次减小 |
 A2(g) +3B2(g)(正反应吸热)下列图像正确的是
A2(g) +3B2(g)(正反应吸热)下列图像正确的是