题目内容
9.NA表示阿伏加德罗常数,以下说法正确的是( )| A. | 31 g白磷含有P-P键的总数为6 NA | |
| B. | 1.6 g NH2?离子含有电子总数为NA | |
| C. | 1 L1 mol•L-1FeCl3溶液中含有Fe3+的数目为NA | |
| D. | 标准状况,22.4 L NO和 22.4 L O2的混合气体所含分子数为1.5NA |
分析 A、求出白磷P4的物质的量,然后根据1mol白磷中含6molp-p键来分析;
B、求出NH2?的物质的量,然后根据1molNH2?中10mol电子来分析;
C、Fe3+是弱碱阳离子,在溶液中会水解;
D、一氧化氮与氧气反应生成二氧化氮,二氧化氮部分转化成四氧化二氮.
解答 解:A、31g白磷P4的物质的量为n=$\frac{31g}{31×4g/mol}$=0.25mol,而1mol白磷中含6molp-p键,故0.25mol白磷中含1.5molp-p键,即1.5NA个,故A错误;
B、1.6gNH2?的物质的量为0.1mol,而1molNH2?中10mol电子,故0.1molNH2?中含1mol电子即NA个,故B正确;
C、Fe3+是弱碱阳离子,在溶液中会水解,故溶液中的铁离子的个数小于NA个,故C错误;
D、标准状况,22.4 L NO和 22.4 L O2的物质的量均为1mol.1mol NO与1mol O2混合后生成1mol二氧化氮,氧气剩余0.5mol,由于部分二氧化氮转化成四氧化二氮,所以气体分子数小于1.5NA,故D错误;
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
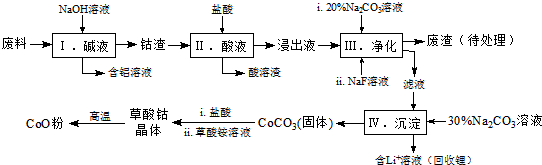
1.钴(Co)及其化合物在工业上有广泛应用.为从某工业废料中回收钴,某学生设计流程如图(废料中含有Al、Li、Co2O3和Fe2O3等物质).
已知:①物质溶解性:LiF难溶于水,Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见表.
请回答:
(1)写出步骤Ⅱ中Co2O3与盐酸反应生成Cl2的离子方程式:Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O.
(2)步骤Ⅲ中 Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH不超过;废渣中的主要成分除了LiF外,还有Fe(OH)3.
(3)NaF 与溶液中的Li+形成LiF沉淀,此反应对步骤Ⅳ所起的作用是降低溶液中Li+浓度,避免步骤Ⅳ中产生Li2CO3沉淀.
(4)在空气中加热5.49g草酸钴晶体(CoC2O4•2H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如表.已知:M(CoC2O4•2H2O)=183g/mol
经测定,210~290℃过程中产生的气体只有CO2,此过程发生反应的化学方程式是3CoC2O4+2O2 $\frac{\underline{\;210℃-290℃\;}}{\;}$Co3O4+6CO2.温度高于890℃时,固体产物发生分解反应,固体产物为CoO.

已知:①物质溶解性:LiF难溶于水,Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见表.
| Fe3+ | Co2+ | Co3+ | Al3+ | |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
(1)写出步骤Ⅱ中Co2O3与盐酸反应生成Cl2的离子方程式:Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O.
(2)步骤Ⅲ中 Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH不超过;废渣中的主要成分除了LiF外,还有Fe(OH)3.
(3)NaF 与溶液中的Li+形成LiF沉淀,此反应对步骤Ⅳ所起的作用是降低溶液中Li+浓度,避免步骤Ⅳ中产生Li2CO3沉淀.
(4)在空气中加热5.49g草酸钴晶体(CoC2O4•2H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如表.已知:M(CoC2O4•2H2O)=183g/mol
| 温度范围/℃ | 固体质量/g |
| 150~210 | 4.41 |
| 290~320 | 2.41 |
| 890~920 | 2.25 |
2.氨水中存在平衡:NH3•H2O?NH4++OH-,当其他条件不变时,改变下列条件,平衡向左移动的是( )
| A. | 通入HCl | B. | 加少量NH4Cl固体 | C. | 加少量NaCl固体 | D. | 通入氨气 |
19.NA为阿伏伽德罗常数.下列说法正确的是( )
| A. | 25℃时pH=13的NaOH溶液中含有OH-的数目为0.1NA | |
| B. | 常温常压下,8gO2含有4NA个电子 | |
| C. | 标准状况下,2024L乙醇含有0.1nA个CH3CH2OH分子 | |
| D. | KIO3+6HI=KI+3H2O+3I2,生产3molI2转移电子的总数为5NA |
14.晶体硅是信息科学和能源科学中的一种重要材料,可用于制芯片和太阳能电池等,.以下是工业上制取纯硅的一种方法.

已知:在一定条件下可发生反应:Si(s)+3HCl(g)?SiHCl3(g)+H2(g)△H<0
I.反应②、③均需要加热,有如下两个温度区间分别供两反应选择,你认为反应②应选择a
(填序号字母),原因是因反应Si(s)+3HCl(g)?SiHCl3(g)+H2(g)△H<0,温度较低时反应向正向进行程度较大,有利于SiHCl3的生成;
a.520~530K b.1350~1360K
II.现在实验室模拟工业上粗硅提纯的过程,已知SiHCl3遇水强烈水解,其他相关数据如下表所示:
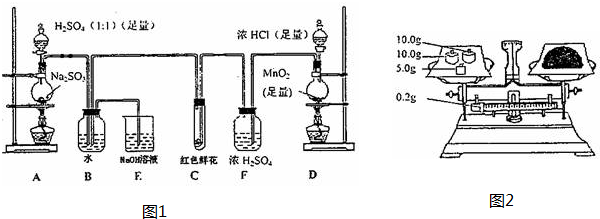
(1)现用如图1装置进行模拟反应②的过程.实验室制HCl的反应原理为:
2NaCl(s)+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ 2HCl↑+Na2SO4

如图2A中是HCl的发生装置,你认为应选择下列哪套装置?d(填装置的序号字母),装置D中碱石灰的作用为吸收剩余HCl、防止空气中的水蒸气进入C装置造成SiHCl3的水解;
(2)已知液态粗品SiHCl3中含有杂质SiCl4、AlCl3、FeCl3等,则流程中操作①为分馏(填操作名称),下列不是该操作所需的仪器是bd(填装置序号字母);
a.冷凝管 b.圆底烧瓶 c.蒸馏烧瓶 d.分液漏斗 e.温度计 f.接受器
(3)用SiHCl3与H2反应制备纯硅的装置如土3
①按图示组装好仪器后,下列实验步骤的正确顺序为dbacef(填步骤的序号字母),
a.打开甲装置分液漏斗旋塞,滴加稀硫酸,反应生成H2;
b.向装置中添加药品;
c.打开丙装置分液漏斗的旋塞,滴加SiHCl3,并加热相应装置;
d.检查装置气密性;
e.停止向丙装置滴加SiHCl3,并停止加热相应装置;
f.停止通H2;
步骤c中需要加热的装置为丙、丁(填装置序号“甲”、“乙”、“丙”、“丁”)
②该套装置的设计缺陷是无尾气处理装置.

已知:在一定条件下可发生反应:Si(s)+3HCl(g)?SiHCl3(g)+H2(g)△H<0
I.反应②、③均需要加热,有如下两个温度区间分别供两反应选择,你认为反应②应选择a
(填序号字母),原因是因反应Si(s)+3HCl(g)?SiHCl3(g)+H2(g)△H<0,温度较低时反应向正向进行程度较大,有利于SiHCl3的生成;
a.520~530K b.1350~1360K
II.现在实验室模拟工业上粗硅提纯的过程,已知SiHCl3遇水强烈水解,其他相关数据如下表所示:
| 物质 | SiCl4 | SiHCl3 | AlCl3 | FeCl3 |
| 沸点/℃ | 57.7 | 33.0 | - | 315 |
| 升华温度/℃ | - | - | 180 | 300 |
2NaCl(s)+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ 2HCl↑+Na2SO4

如图2A中是HCl的发生装置,你认为应选择下列哪套装置?d(填装置的序号字母),装置D中碱石灰的作用为吸收剩余HCl、防止空气中的水蒸气进入C装置造成SiHCl3的水解;
(2)已知液态粗品SiHCl3中含有杂质SiCl4、AlCl3、FeCl3等,则流程中操作①为分馏(填操作名称),下列不是该操作所需的仪器是bd(填装置序号字母);
a.冷凝管 b.圆底烧瓶 c.蒸馏烧瓶 d.分液漏斗 e.温度计 f.接受器
(3)用SiHCl3与H2反应制备纯硅的装置如土3
①按图示组装好仪器后,下列实验步骤的正确顺序为dbacef(填步骤的序号字母),
a.打开甲装置分液漏斗旋塞,滴加稀硫酸,反应生成H2;
b.向装置中添加药品;
c.打开丙装置分液漏斗的旋塞,滴加SiHCl3,并加热相应装置;
d.检查装置气密性;
e.停止向丙装置滴加SiHCl3,并停止加热相应装置;
f.停止通H2;
步骤c中需要加热的装置为丙、丁(填装置序号“甲”、“乙”、“丙”、“丁”)
②该套装置的设计缺陷是无尾气处理装置.
19.下列物质中不能由单质直接化合生成的是( )
①CuS ②FeS ③SO3 ④H2O ⑤FeCl2 ⑥NH3.
①CuS ②FeS ③SO3 ④H2O ⑤FeCl2 ⑥NH3.
| A. | ①③⑤ | B. | ②④⑤ | C. | ①②④⑤ | D. | ①②③④⑤⑥ |