题目内容
如图所示,把下列物质分别加入装有水的锥形瓶里,立即塞紧带有U形管的塞子,已知U形管内预先装有少量水(为方便观察,预先将水染成红色),结果U形管左边液面升高,则加入的物质可能是( )。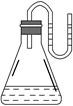
| A.NaOH固体 | B.浓硫酸 | C.NH4NO3晶体 | D.Na2O2固体 |
C
解析

练习册系列答案
相关题目
下列过程有热量放出的是
| A.断开氢气中的H-H键 |
| B.C与H2O(g)反应 |
| C.Ba(OH)2·8H2O晶体与NH4Cl晶体反应 |
| D.Na与H2O反应 |
25℃、101kPa下,碳、氢气和甲烷的燃烧热依次是393.5 kJ·mol—1、285.8 kJ·mol—1
和890.3kJ·mol—1,下列选项中正确的是
| A.2H2(g)+O2(g)=2H2O(l)△H=—285.8kJ·mol—1 |
| B.CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=+890.3kJ·mol—1 |
| C.H2(g)+1/2O2(g)=H2O(g)△H<—285.8kJ·mol—1 |
| D.C(s)+2H2(g)=CH4(g)△H=—74.8 kJ·mol—1 |
下列图示与对应的叙述相符的是
| A.图1表示向某硫酸和硫酸铝混合溶液中加入NaOH溶液,沉淀质量与加入NaOH溶液体积的关系 |
| B.图2表示25℃时,用0.1mol?L-1盐酸滴定20mL0.1mol?L-1NaOH溶液的pH随加入盐酸体积的变化 |
| C.图3表示t℃时稀释冰醋酸过程中溶液导电性的变化 |
| D.根据图4可判断某可逆反应的正反应是吸热反应 |
盖斯定律认为:不管化学过程是一步或分为数步完成,这个过程的热效应是相同的。
已知:H2O(g)= H2O(l) △H1 =-Q1 kJ·mol-1(Q1>0)
C2H5OH(g)= C2H5OH(l) △H2 =-Q2 kJ·mol-1(Q2>0)
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) △H3 = -Q3 kJ·mol-1(Q3>0)若使23g液态乙醇完全燃烧,最后恢复到室温,则放出的热量为(kJ)
| A.Q1+ Q2+Q3 | B.0.5(Q1+Q2+Q3 ) |
| C.0.5 Q1-1.5 Q2+0.5Q3 | D.1.5 Q1-0.5 Q2+0.5Q3 |
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是( )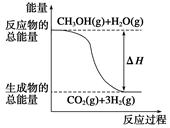
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+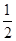 O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
下列说法正确的是( )
| A.CH3OH的燃烧热为192.9 kJ·mol-1 |
| B.反应①中的能量变化如图所示 |
| C.CH3OH转变成H2的过程一定要吸收能量 |
D.根据②推知反应:CH3OH(l)+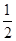 O2(g)=CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1 O2(g)=CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1 |
在下列反应中,生成物的能量总和高于反应物的能量总和的是
| A.Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s) 放热反应 |
| B.2CO(g)+O2(g)=2CO2(g) 放热反应 |
| C.CaCO3(s)=CaO(s)+CO2 吸热反应 |
| D.H+(aq)+OH-(aq)=H2O(l) 放热反应 |
化学反应A2+B2=2AB的能量变化如图所示,则下列说法正确的是( )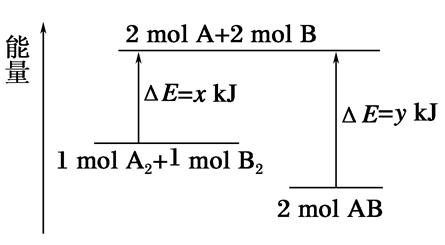
| A.该反应是吸热反应 |
| B.断裂1mol A—A键和1mol B—B键能放出xkJ的能量 |
| C.断裂2mol A—B键需要吸收ykJ的能量 |
| D.2mol AB的总能量高于1 mol A2和1mol B2的总能量 |
用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。
反应A:4HCl+O2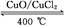 2Cl2+2H2O
2Cl2+2H2O
已知:Ⅰ.反应A中,4 mol HCl被氧化,放出115.6 kJ的热量。
Ⅱ.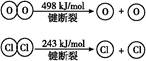
判断下列说法正确的是( )
| A.反应A的ΔH>-115.6 kJ/mol |
| B.断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为32 kJ |
| C.H2O中H—O键比HCl中H—Cl键弱 |
| D.由Ⅱ中的数据判断氯元素的非金属性比氧元素强 |