题目内容
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:
(1)氮元素与氢元素可组成多种微粒,如NH3、NH4+、肼(N2H4)等.分析常见的H2O与H2O2、CH4与C2H6的分子结构,写出N2H4的电子式 .NH3与NaClO反应可得到N2H4,该反应的化学方程式为 ;
(2)如图是工业生产硝酸铵的流程示意图.
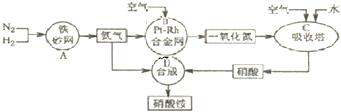
①A、B、C、D四个容器中的反应,属于氧化还原反应的是 (填字母).
②某化肥厂用氨气制硝酸铵,已知氨气制NO的产率是96%,NO制硝酸的产率是92%,则制硝酸所用的氨气的质量占总氨气质量的 %(不考虑生产中的其它损耗 ).
(3)科学家一直致力于研究常温、常压下“人工固氮”的新方法.曾有实验报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3.进一步研究NH3生成量与温度的关系,部分实验数据见下表(光照、N2压力1.0×105Pa、反应时间3h):
相应的化学方程式:N2(g)+3H2O(l)?2NH3(g)+
O2(g)△H=+765.2kJ?mol-1
回答下列问题:
①该反应在较低温度下能否自发进行? ;
②从323K到353K,氨气的生成量减少的原因 .
(4)在25℃下,将a mol?L-1的氨水与0.01mol?L-1的盐酸等体积混合,反应时溶液中c(NH4+)=c(Cl-).用含a的代数式表示NH3?H2O的电离常数Kb= .
(1)氮元素与氢元素可组成多种微粒,如NH3、NH4+、肼(N2H4)等.分析常见的H2O与H2O2、CH4与C2H6的分子结构,写出N2H4的电子式
(2)如图是工业生产硝酸铵的流程示意图.

①A、B、C、D四个容器中的反应,属于氧化还原反应的是
②某化肥厂用氨气制硝酸铵,已知氨气制NO的产率是96%,NO制硝酸的产率是92%,则制硝酸所用的氨气的质量占总氨气质量的
(3)科学家一直致力于研究常温、常压下“人工固氮”的新方法.曾有实验报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3.进一步研究NH3生成量与温度的关系,部分实验数据见下表(光照、N2压力1.0×105Pa、反应时间3h):
| T/K | 303 | 313 | 323 | 353 |
| NH3生成量/(10-6 mol) | 4.8 | 5.9 | 6.0 | 2.0 |
| 3 |
| 2 |
回答下列问题:
①该反应在较低温度下能否自发进行?
②从323K到353K,氨气的生成量减少的原因
(4)在25℃下,将a mol?L-1的氨水与0.01mol?L-1的盐酸等体积混合,反应时溶液中c(NH4+)=c(Cl-).用含a的代数式表示NH3?H2O的电离常数Kb=
考点:电子式,氧化还原反应,反应热和焓变,化学平衡的调控作用,弱电解质在水溶液中的电离平衡
专题:基本概念与基本理论
分析:(1)N2H4为共价化合物,分子中存在4个氮氢键,氮原子最外层达到8电子稳定结构,据此写出其电子式;氨气与次氯酸钠反应生成N2H4和氯化钠,根据化合价升降相等配平反应的化学方程式;
(2)①根据ABCD的反应中是否有化合价变化判断是否属于氧化还原反应;
②根据NH3制NO的产率是96%、NO制HNO3的产率是92%,利用氮原子守恒来计算硝酸的量,再由HNO3跟NH3反应生成NH4NO3来计算氨气的量,最后计算制HNO3所用去的NH3的质量占总耗NH3质量的百分数;
(3)①当△G=△H-T?△S<0时,反应能自发进行;
②该正反应为吸热反应,升高温度,氨的含量应增大,但从323K到353K,氨气的生成量减少,只能是发生了其他反应;
(4)根据溶液的pH值计算溶液中c(OH-),根据氯离子浓度计算c(NH4+),利用物料守恒计算溶液中c(NH3?H2O),代入NH3?H2O的电离常数表达式计算.
(2)①根据ABCD的反应中是否有化合价变化判断是否属于氧化还原反应;
②根据NH3制NO的产率是96%、NO制HNO3的产率是92%,利用氮原子守恒来计算硝酸的量,再由HNO3跟NH3反应生成NH4NO3来计算氨气的量,最后计算制HNO3所用去的NH3的质量占总耗NH3质量的百分数;
(3)①当△G=△H-T?△S<0时,反应能自发进行;
②该正反应为吸热反应,升高温度,氨的含量应增大,但从323K到353K,氨气的生成量减少,只能是发生了其他反应;
(4)根据溶液的pH值计算溶液中c(OH-),根据氯离子浓度计算c(NH4+),利用物料守恒计算溶液中c(NH3?H2O),代入NH3?H2O的电离常数表达式计算.
解答:
解:(1)根据H2O与H2O2、CH4与C2H6的分子结构可知,N2H4的电子式中存在4个氮氢键,氮原子最外层达到8电子稳定结构,所以其电子式为: ;氨气与次氯酸钠反应生成N2H4,次氯酸中氯元素有+1价变为-1价的氯离子,化合价降低了2价,氨气的氮元素化合价有-3价升高为-2价,升高了1价,所以氨气的计量数为2,次氯酸钠的计量数为1,根据观察法配平后的反应方程式为:2NH3+NaClO═N2H4+NaCl+H2O,
;氨气与次氯酸钠反应生成N2H4,次氯酸中氯元素有+1价变为-1价的氯离子,化合价降低了2价,氨气的氮元素化合价有-3价升高为-2价,升高了1价,所以氨气的计量数为2,次氯酸钠的计量数为1,根据观察法配平后的反应方程式为:2NH3+NaClO═N2H4+NaCl+H2O,
故答案为: ;2NH3+NaClO═N2H4+NaCl+H2O;
;2NH3+NaClO═N2H4+NaCl+H2O;
(2)①反应A为氮气与氢气合成氨的反应,该反应中有化合价变化,属于氧化还原反应;
反应B为氨气的催化氧化,氨气中氮元素有-3价升高到一氧化氮中的+2价,该反应属于氧化还原反应;
反应C为NO与氧气反应生成二氧化氮,该反应属于氧化还原反应;
反应D为氨气与硝酸反应生成硝酸铵,该反应中没有化合价变化,不属于氧化还原反应;
所以属于氧化还原反应的为:ABC,
故答案为:ABC;
②由NH3制NO的产率是96%、NO制HNO3的产率是92%,根据氮原子守恒可知,NH3~NO~HNO3,则1mol氨气可得到硝酸1mol×96%×92%=0.8832mol,由HNO3+NH3═NH4NO3,则该反应消耗的氨气的物质的量为0.8832mol,氨气的质量之比等于物质的量之比,
则制HNO3所用去的NH3的质量占总耗NH3质量的百分数为:
×100%=53.1%,
故答案为:53.1;
(3)①因该反应的△H>,△S>0,根据△G=△H-T?△S<0反应可自发进行,故低温时△G>0,所以低温时不能自发进行;
故答案为:不能;
(2)根据N2(g)+3H2O(l)?2NH3(g)+
O2(g)△H=+765.2kJ?mol-1,此正反应为吸热反应,根据平衡移动原理,升高温度,平衡向吸热方向移动,氨的量应增加,从303K-323K,符合平衡移动规律,但从323K-353K,氨的量随温度的升高而降低,不符合平衡移动原理,只能是发生了其他反应,即在高温下,氨气易被氧气氧化生成一氧化氮和水,
故答案为:氨气在高温下被氧气氧化;
(4)溶液中存在电荷守恒,c(NH4+)+c(H+)=c(Cl-)+c(OH-),由于c(NH4+)=c(Cl-),故c(H+)=c(OH-),溶液呈中性,故溶液中c(OH-)=10-7mol/L,溶液中c(NH4+)=c(Cl-)=
×0.01mol?L-1=0.005mol?L-1,故混合后溶液中c(NH3.H2O)=
×amol?L-1-0.005mol?L-1=(0.5a-0.005)mol/L,NH3?H2O的电离常数Kb=
=
,
故答案为:
.
 ;氨气与次氯酸钠反应生成N2H4,次氯酸中氯元素有+1价变为-1价的氯离子,化合价降低了2价,氨气的氮元素化合价有-3价升高为-2价,升高了1价,所以氨气的计量数为2,次氯酸钠的计量数为1,根据观察法配平后的反应方程式为:2NH3+NaClO═N2H4+NaCl+H2O,
;氨气与次氯酸钠反应生成N2H4,次氯酸中氯元素有+1价变为-1价的氯离子,化合价降低了2价,氨气的氮元素化合价有-3价升高为-2价,升高了1价,所以氨气的计量数为2,次氯酸钠的计量数为1,根据观察法配平后的反应方程式为:2NH3+NaClO═N2H4+NaCl+H2O,故答案为:
 ;2NH3+NaClO═N2H4+NaCl+H2O;
;2NH3+NaClO═N2H4+NaCl+H2O;(2)①反应A为氮气与氢气合成氨的反应,该反应中有化合价变化,属于氧化还原反应;
反应B为氨气的催化氧化,氨气中氮元素有-3价升高到一氧化氮中的+2价,该反应属于氧化还原反应;
反应C为NO与氧气反应生成二氧化氮,该反应属于氧化还原反应;
反应D为氨气与硝酸反应生成硝酸铵,该反应中没有化合价变化,不属于氧化还原反应;
所以属于氧化还原反应的为:ABC,
故答案为:ABC;
②由NH3制NO的产率是96%、NO制HNO3的产率是92%,根据氮原子守恒可知,NH3~NO~HNO3,则1mol氨气可得到硝酸1mol×96%×92%=0.8832mol,由HNO3+NH3═NH4NO3,则该反应消耗的氨气的物质的量为0.8832mol,氨气的质量之比等于物质的量之比,
则制HNO3所用去的NH3的质量占总耗NH3质量的百分数为:
| 1mol |
| 1mol+0.8832mol |
故答案为:53.1;
(3)①因该反应的△H>,△S>0,根据△G=△H-T?△S<0反应可自发进行,故低温时△G>0,所以低温时不能自发进行;
故答案为:不能;
(2)根据N2(g)+3H2O(l)?2NH3(g)+
| 3 |
| 2 |
故答案为:氨气在高温下被氧气氧化;
(4)溶液中存在电荷守恒,c(NH4+)+c(H+)=c(Cl-)+c(OH-),由于c(NH4+)=c(Cl-),故c(H+)=c(OH-),溶液呈中性,故溶液中c(OH-)=10-7mol/L,溶液中c(NH4+)=c(Cl-)=
| 1 |
| 2 |
| 1 |
| 2 |
| 10-7×0.005 |
| 0.5a-0.005 |
| 10-9 |
| a-0.01 |
故答案为:
| 10-9 |
| a-0.01 |
点评:本题考查了电子式的书写、氧化还原反应的判断、电离平衡常数的计算、化学方程式的书写等知识,题目难度稍大,试题题量较大,涉及的知识点较多,充分考查了学生的分析、理解能力及灵活应用所学知识的能力.

练习册系列答案
 期末集结号系列答案
期末集结号系列答案
相关题目
常温下,将乙酸和氢氧化钠溶液混合,所得溶液pH=7,则此溶液中( )
| A、c(CH3COO-)>c(Na+) |
| B、c(CH3COO-)<c(Na+) |
| C、c(CH3COO-)=c(Na+) |
| D、无法确定c(CH3COO-)与c(Na+)的关系 |
CO2通入下列各溶液中,不能产生沉淀的是( )
| A、CaCl2溶液 |
| B、Na2SiO3溶液 |
| C、Ca(OH)2溶液 |
| D、Ba(OH)2溶液 |
下列气体中,既可用浓硫酸干燥,又可以用碱石灰干燥的是( )
| A、NO2 |
| B、SO2 |
| C、NH3 |
| D、O2 |
下列物质结构的化学用语或模型正确的是( )
| A、乙醇的结构简式:CH3CH2OH |
B、HF的电子式: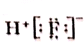 |
C、氯离子的结构示意图: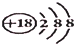 |
D、CH4分子的球棍模型: |
 一根细如发丝的光缆可以同时传导上千部电话,是铜导线传导能力的约100倍左右.“光缆无铜,盗割有罪”.试问:光缆主要是以
一根细如发丝的光缆可以同时传导上千部电话,是铜导线传导能力的约100倍左右.“光缆无铜,盗割有罪”.试问:光缆主要是以