题目内容
【题目】水溶液中的行为是中学化学的重要内容,按要求回答下列问题.
(1)在醋酸水溶液中存在平衡CH3COOH![]() CH3COO-+H+若分别改变下列条件:①加水稀释②加热③加少量固体醋酸钠,其中能使醋酸电离程度增大的是_______,能使溶液pH增大的是_______(填序号)。
CH3COO-+H+若分别改变下列条件:①加水稀释②加热③加少量固体醋酸钠,其中能使醋酸电离程度增大的是_______,能使溶液pH增大的是_______(填序号)。
(2)常温下,0.1mol·L-1NaHCO3溶液的pH大于8,则溶液中Na+、HCO3-、CO32-、OH-四种微粒的浓度由大到小的顺序为:________________________________。
(3)AlCl3溶液加热蒸干并灼烧最终得到物质是________(填化学式),将NaHCO3与Al2(SO4)3溶液混合后可做泡沫灭火剂,其原理是_______(用离子方程式表示)。
(4)已知下列物质在20℃下的Ksp如下:
化学式 | AgCl | AgBr | AgI |
颜色 | 白色 | 浅黄色 | 黄色 |
Ksp | 2.0×10-10 | 5.4×10-13 | 8.3×10-17 |
①当向含相同浓度Cl-、Br-、I-的溶液中滴加AgNO3溶液时,_______先沉淀(填离子符号),
②向BaCl2溶液中加入AgNO3和KBr,当两种淀共存时,  =__________。
=__________。
【答案】 ①② ①③ c(Na+)>c(HCO3-)>c(OH-)>c(CO32-)>c(H+) Al2O3 3HCO3-+Al3+=Al(OH)3↓+3CO2↑ I- 2.7×10-3
【解析】(1)醋酸存在电离平衡CH3COOH![]() H++CH3COO-,电离故事吸热过程,加热、加水稀释、加入碱性物质均能使电离平衡向右移动,能使醋酸电离程度增大的是:①加水稀释;②加热;答案选①②;①加水稀释氢离子浓度减小,溶液pH增大;②加热促进电离氢离子浓度增大,pH减小;③加少量固体醋酸钠,醋酸根离子浓度增大,抑制醋酸电离,氢离子浓度减小,pH增大;能使溶液pH增大的是①③;(2)常温下,0.1mol·L-1NaHCO3溶液的pH大于8,c(OH-)>c(H+),说明HCO3-水解程度大于其电离程度,故c(Na+)>c(HCO3-)、c(H2CO3)>c(CO32-),水解程度不大所以c(HCO3-)>c(H2CO3)、c(HCO3-)>c(OH-),溶液中氢氧根来源于水的电离与HCO3-水解,故c(OH-)>c(H2CO3),所以c(Na+)>c(HCO3-)>c(OH-)>c(H2CO3)>c(CO32-);(3)AlCl3溶液在加热时水解生成Al(OH)3,生成的HCl易挥发,最终生成Al(OH)3,在加强热时,Al(OH)3不稳定,分解生成Al2O3;Al2(SO4)3溶液中,硫酸铝水解生成氢氧化铝和硫酸,Al2(SO4)3+6H2O
H++CH3COO-,电离故事吸热过程,加热、加水稀释、加入碱性物质均能使电离平衡向右移动,能使醋酸电离程度增大的是:①加水稀释;②加热;答案选①②;①加水稀释氢离子浓度减小,溶液pH增大;②加热促进电离氢离子浓度增大,pH减小;③加少量固体醋酸钠,醋酸根离子浓度增大,抑制醋酸电离,氢离子浓度减小,pH增大;能使溶液pH增大的是①③;(2)常温下,0.1mol·L-1NaHCO3溶液的pH大于8,c(OH-)>c(H+),说明HCO3-水解程度大于其电离程度,故c(Na+)>c(HCO3-)、c(H2CO3)>c(CO32-),水解程度不大所以c(HCO3-)>c(H2CO3)、c(HCO3-)>c(OH-),溶液中氢氧根来源于水的电离与HCO3-水解,故c(OH-)>c(H2CO3),所以c(Na+)>c(HCO3-)>c(OH-)>c(H2CO3)>c(CO32-);(3)AlCl3溶液在加热时水解生成Al(OH)3,生成的HCl易挥发,最终生成Al(OH)3,在加强热时,Al(OH)3不稳定,分解生成Al2O3;Al2(SO4)3溶液中,硫酸铝水解生成氢氧化铝和硫酸,Al2(SO4)3+6H2O![]() 2Al(OH)3+3H2SO4,硫酸是难挥发性的酸,加热蒸干并灼烧最终得到物质是Al2(SO4)3,将NaHCO3与Al2(SO4)3两者溶液混合后可做泡沫灭火剂是利用二者发生双水解生成氢氧化铝沉淀和二氧化碳,反应的离子方程式为:3HCO3-+Al3+=Al (OH)3 ↓+3CO2↑;(4)①向含相同 浓度Cl-、Br-、I-的溶液中滴加AgNO3溶液时AgCl、AgBr、AgI三者的浓度积Qc相等,因为Ksp(AgI)最小,所以首先Qc>Ksp的为AgI其次为AgBr最后为AgCl,故先沉淀的离子为I-;②向BaCl2 溶液中加入AgNO3和KBr,当两种沉淀共存时,
2Al(OH)3+3H2SO4,硫酸是难挥发性的酸,加热蒸干并灼烧最终得到物质是Al2(SO4)3,将NaHCO3与Al2(SO4)3两者溶液混合后可做泡沫灭火剂是利用二者发生双水解生成氢氧化铝沉淀和二氧化碳,反应的离子方程式为:3HCO3-+Al3+=Al (OH)3 ↓+3CO2↑;(4)①向含相同 浓度Cl-、Br-、I-的溶液中滴加AgNO3溶液时AgCl、AgBr、AgI三者的浓度积Qc相等,因为Ksp(AgI)最小,所以首先Qc>Ksp的为AgI其次为AgBr最后为AgCl,故先沉淀的离子为I-;②向BaCl2 溶液中加入AgNO3和KBr,当两种沉淀共存时, 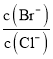 =
=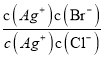 =
=![]() =
=![]() =2.7×10-3。
=2.7×10-3。