题目内容
【题目】如图所示,锥形瓶和分液漏斗内的液体均是水,向烧杯内滴加水时,发现U形管内液体慢慢右移,恢复到原温度后,左边与右边液面基本相平,则烧杯内的物质是( )

A.过氧化钠B.氯化钠C.钠D.氧化钠
【答案】D
【解析】
向烧杯内滴加水时,发现U形管内液体慢慢右移,说明容器内气体的压强增大,恢复到原温度后,左边与右边液面基本相平,说明过程中没有气体生成,是温度升高的结果,据此分析解答。
A.过氧化钠溶于水放出热量并生成氧气,使容器内温度升高,压强增大,U形管内液体慢慢右移,但恢复到原温度后左边液面仍然比右边低,故A错误;
B.氯化钠溶于水,没有明显的热效应,U形管内液体不会移动,故B错误;
C.钠与水反应放热并生成氢气,使容器内温度升高,压强增大,U形管内液体慢慢右移,但恢复到原温度后左边液面仍然比右边低,故C错误;
D.氧化钠与水反应放出热量,使容器内温度升高,压强增大,U形管内液体慢慢右移,恢复到原温度后左边液面与右边基本相平,故D正确;
故选D。

 小学课时特训系列答案
小学课时特训系列答案【题目】随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金的维生素”。为回收利用含钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,回收率达91.7%以上。部分含钒物质在水中的溶解性如下表所示:
物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
该工艺的主要流程如下。

请回答下列问题:
(1)请写出加入Na2SO3溶液发生反应的离子方程式_________。
(2)催化氧化所使用的催化剂钒触媒(V2O5)能加快二氧化硫氧化速率,此过程中产生了一连串的中间体(如下图)。其中a、c二步的化学方程式可表示为_________________,______________。
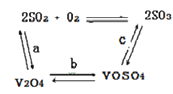
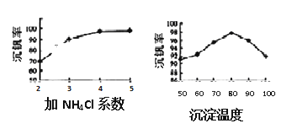
(3)该工艺中沉矾率是回收钒的关键之一,沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度。根据下图试建议控制氯化铵系数为_________,控制温度的方法为_________________。
(4)将滤液1和滤液2混合后用氯酸钾氧化,氯元素被还原为最低价,其反应的离子反应方程式为___。
(5)经过热重分析测得:NH4VO3在焙烧过程中,固体质量的减少值(纵坐标)随温度变化的曲线如图所示。则NH4VO3在分解过程中_________。

A.先分解失去H2O,再分解失去NH3 B.先分解失去NH3,再分解失去H2O
C.同时分解失去H2O和NH3D.同时分解失去H2、N2和H2O
(6)全钒电池的电解质溶液为VOSO4溶液,电池的工作原理为VO2+ + V2++2H+ ![]() VO2+ +H2O +V3+。电池充电时阳极的电极反应式为___________。
VO2+ +H2O +V3+。电池充电时阳极的电极反应式为___________。






