题目内容
【题目】原电池是化学对人类的一项重大贡献。
(1)某兴趣小组为研究原电池原理,设计如图装置。
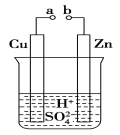
①a和b不连接时,烧杯中发生反应的离子方程式是 ________________________________________。
②a和b用导线连接,Cu极为原电池________极(填“正”或“负”),该电极反应式是_____________________________,溶液中的H+移向________(填“Cu”或“Zn”)极。
③无论a和b是否连接,Zn片均被腐蚀,若转移了0.2 mol电子, 则理论上Zn片质量减轻________g。
(2)如图是甲烷燃料电池原理示意图,回答下列问题:
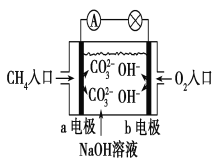
①电池的负极是________(填“a”或“b”)电极,该极的电极反应式为: _________________________。
②电池工作一段时间后电解质溶液的pH__________(填“增大”“减小”或“不变”)。
【答案】(1)①Zn+2H+===Zn2++H2↑
②正;2H++2e-===H2↑;Cu;
③6.5
(2)①a;CH4+10OH--8e-===CO32-+7H2O;
②减小
【解析】
试题分析:分析本题装置,若a和b不连接,不能构成原电池;若a和b连接,则符合构成原电池的条件。(1)①若a、b不连接则发生的是Zn和H2SO4的置换反应,离子方程式为:Zn+2H+===Zn2++H2↑。
故答案为:Zn+2H+===Zn2++H2↑;
②a、b连接后,构成原电池,Cu的活泼性弱于Zn,Cu为正极,Zn为负极;正极电极反应为:2H++2e-===H2↑;溶液中的H+移向Cu极。
故答案为:正;2H++2e-===H2↑;Cu;
③若转移0.2 mol电子,则消耗0.1 mol Zn,其质量为6.5 g。
故答案为:6.5g;
(2)CH4在反应时失去电子,故a电极是电池的负极。电极反应式可由总反应式CH4+2OH-+2O2===CO+3H2O减去正极反应式O2+2H2O+4e-===4OH-,求得。由于电池工作过程中会消耗OH-,故一段时间后,电解质溶液的pH会减小。
故答案为:①a;CH4+10OH--8e-===CO32-+7H2O;②减小。

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案【题目】以下为三种有机物的有关信息,根据表中信息回答问题.
A | B | C |
其产量用来衡量一个国家的石油化工水平. | 比例模型为:
| 沼气主要成分 |
(1)A结构简式是_____________。该物质能使酸性高锰酸钾溶液和溴的四氯化碳溶液褪色。其中,与高锰酸钾溶发生的反应是_______________(填反应类型);与溴反应的化学方程式为_____________,当溴的四氯化碳溶液质量增加2.8g时,生成物的质量为__________。
(2)工业上,B来源于煤干馏后的液态产物煤焦油.B与浓硝酸发生取代反应,该反应的化学方程式为__________。
(3)C与氯气反应能生成二氯代物,请写出该反应的化学方程式为__________。
【题目】甲、乙、丙、丁的相互转化关系如图所示(部分反应物及反应条件已略去,箭头表示一步转化)。下列各组物质中,不能满足图示转化关系的是
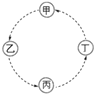
选项 | 甲 | 乙 | 丙 | 丁 |
A |
| CH2=CH2 | CH2BrCH2Br | CH2OHCH2OH |
B | NaAlO2 | Al(OH)3 | Al2O3 | Al |
C | CH3CH2OH | CH3CHO | CH3COOH | CH3COOC2H5 |
D | SiO2 | H2SiO3 | Na2SiO3 | Si |