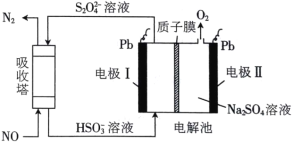
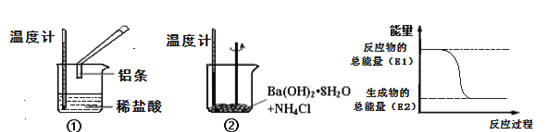
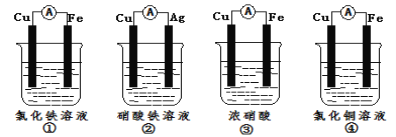
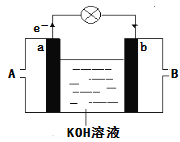
题目内容
【题目】有关物质的量的计算:
(1)2 mol尿素[CO(NH2)2]含__个H原子,所含氧原子跟_____g H2O所含氧原子个数相等。
(2)2.4g 镁中含______mol电子,在与足量盐酸反应中产生标准状况下的氢气体积为 ______L。
(3)30.9gNaR含有Na+ 0.3mol,则NaR的摩尔质量为_____。
【答案】8NA或 4.816×1024 36 1.2 2.24 103g·mol-1
【解析】
(1)2 mol尿素[CO(NH2)2]中氢原子的物质的量为2 mol×4=8mol,则含H原子8NA或 4.816×1024个;2 mol尿素[CO(NH2)2]中氧原子的物质的量为2 mol×1=2mol,所含氧原子为2NA,若与H2O所含氧原子个数相等,即H2O中氧原子的物质的量2mol,则水的物质的量为2mol,水的质量=2mol×18g/mol=36g,
答案为:8NA或 4.816×1024;36;
(2)2.4g镁的物质的量为![]() =0.1mol,一个镁原子含有12个电子,则镁原子含有0.1mol×12=1.2mol电子;根据反应Mg+2HCl=MgCl2+H2↑,0.1molMg完全反应生成0.1mol H2,标准状况下,0.1mol H2的体积为0.1mol×22.4L/mol=2.24L,
=0.1mol,一个镁原子含有12个电子,则镁原子含有0.1mol×12=1.2mol电子;根据反应Mg+2HCl=MgCl2+H2↑,0.1molMg完全反应生成0.1mol H2,标准状况下,0.1mol H2的体积为0.1mol×22.4L/mol=2.24L,
答案为:1.2;2.24;
(3)1molNaR含有1mol钠离子,则30.9gNaR含有Na+0.3mol,NaR物质的量为0.3mol,其摩尔质量为![]() =103g/mol,
=103g/mol,
答案为:103g/mol。

 阅读快车系列答案
阅读快车系列答案【题目】下表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0族 |
第二周期 | ① | ② | ③ | |||||
第三周期 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
第四周期 | ⑨ | ⑩ |
(1)在这些元素中,化学性质最不活泼的是:__(填元素符号),
(2)在最高价氧化物对应的水化物中,酸性最强的化合物的分子__,碱性最强的化合物的电子式是:__。
(3)用电子式表示元素④与⑥的化合物的形成过程:__。
(4)表示①与⑦的化合物的电子式__,该化合物是由__(填“极性”或“非极性”)键形成的。
(5)③、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是_(用化学式表示)。
(6)元素③的简单氢化物的结构式__,在常温下和元素⑦的单质反应的离子方程式__。
【题目】温度分别为T1和T2时,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)![]() 2Z(g),一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g),一段时间后达到平衡,反应过程中测定的数据如下表:
温度/K | t/min | t1 | t2 | t3 | t4 |
T1 | n(Y)/mol | 0.14 | 0.12 | 0.10 | 0.10 |
T2 | n(Y)/mol | 0.13 | 0.09 | 0.08 |
下列说法正确的是( )
A. 该反应的正反应为放热反应
B. T2温度下此反应的平衡常数K=4
C. 温度为T1时,0~t1时间段的平均速率υ(Z)=2.0×10-3mol·L-1·min-1
D. 在T1下平衡后,保持其他条件不变,再充入0.2molZ,平衡时X的体积分数增大