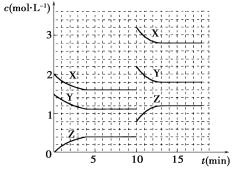
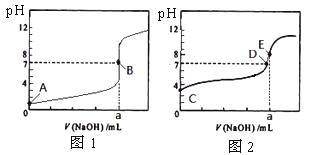
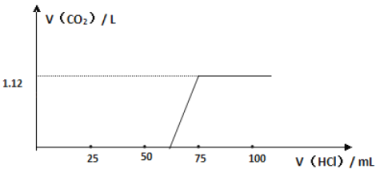
题目内容
【题目】(1)配平方程式 KMnO4+ HCl(浓)- KCl+ MnCl2+ Cl2↑+ H2O,并用双线法分析此反应;___。
(2)指出___是氧化剂,___元素被氧化,氧化产物是___,此反应中,HCl表现的性质有___性和___性。
【答案】 KMnO4 Cl Cl2 还原(酸) 酸(还原)
KMnO4 Cl Cl2 还原(酸) 酸(还原)
【解析】
反应中锰元素化合价+7价变化为+2价,电子转移5e-,氯元素化合价-1价变化为0价,电子转移2e-,电子转移总数为10e-,结合原子守恒、电荷守恒和电子守恒配平书写;根据物质的性质解析。
(1)反应中锰元素化合价+7价变化为+2价,电子转移5e-,氯元素化合价-1价变化为0价,电子转移2e-,电子转移总数为10e-,结合原子守恒、电荷守恒和电子守恒配平书写标记电子转移的化学方程式为: ;
;
(2)化学方程式为2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,其中KMnO4是氧化剂、HCl是还原剂,部分氯元素被氧化,HCl中部分起酸性作用,没有发生氧化反应,此反应中,HCl表现的性质有酸性和还原性。

【题目】实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL。根据这两种溶液的配制情况回答下列问题。
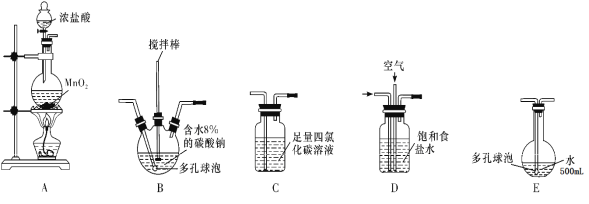
(1)在下图所示仪器中,配制上述溶液肯定不需要的是_________(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是__________。
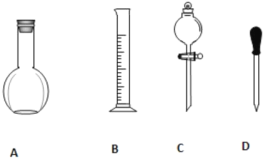
(2)在容量瓶的使用方法中,下列操作不正确的是____________
A.使用容量瓶前检验是否漏水 |
B.容量瓶用水洗净后,再用待配溶液洗涤 |
C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。 |
D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。 |
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀。
(3)根据计算用托盘天平称取的质量为______g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度_____0.1mol/L(填“大于”“小于”或“等于”)。
(4)根据计算得知,需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为_______mL,如果实验室有15mL、20mL、50mL量筒,应选用______mL量筒最好。