题目内容
15.相等物质的量的CO和CO2相比较,下列有关叙述中正确的是( )①它们所含的分子数目之比为1:1
②它们所含的O原子数目之比为1:2
③它们的体积之比为1:1
④它们所含的C原子数目之比为1:1
⑤它们所含的电子数目之比为7:11.
| A. | ①④⑤ | B. | ②③⑤ | C. | ①②④⑤ | D. | ①②③④⑤ |
分析 根据N=nNA计算微粒数目.
①物质的量相同,分子数相同;
②1个CO和CO2分子中所含氧原子数分别为1个、2个;
③气体存在的条件未知,不能确定体积大小;
④1个CO和CO2分子中所含碳原子数都是1个;
⑤CO和CO2分子中所含电子数分别为14个、22个.
解答 解:①由于N=nNA,所以物质的量相同,分子数相同,故①正确;
②CO和CO2分子中所含氧原子数分别为1个、2个,相等物质的量的CO和CO2所含氧原子的物质的量之比为1:2,由于N=nNA,所含氧原子数之比为1:2,故②正确;
③气体存在的条件未知,不能确定体积大小,故③错误;
④CO和CO2分子中所含碳原子数都是1个,相等物质的量的CO和CO2所含碳原子的物质的量之比为1:1,由于N=nNA,所含碳原子数之比为1:1,故④正确;
⑤CO和CO2分子中所含电子数分别为14个、22个,相等物质的量的CO和CO2所含电子的物质的量之比为14:22=7:11,由于N=nNA,所含电子数之比为7:11,故⑤正确.
故选C.
点评 本题考查常用化学计量的有关计算、阿伏伽德罗定律及推论,题目难度不大,注意有关公式的利用与影响气体体积的因素.

练习册系列答案
相关题目
5.反应2SO2+O2?2SO3过程中的能量变化曲线如图所示,下列说法中正确的是( )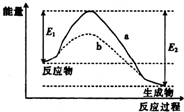

| A. | 由图可知,SO2和O2的总能量一定高于SO3的能量 | |
| B. | 使用正催化剂,E1数值减小 | |
| C. | 曲线b相对曲线a,改变的条件可能是升高温度 | |
| D. | 因该反应为放热反应,故该反应不需要加热 |
6.表中所列欲进行分离的混合物,在甲组中选出所用的试剂、乙组中选出所用的主要方法,将其序号填入表中相应栏中.
甲组:①水 ②氢氧化钠溶液 ③汽油 ④食盐 ⑤乙醇 ⑥生石灰
乙组:A.结晶 B.蒸馏 C.萃取 D.分液 E.盐析 F.渗析 G.纸层析
甲组:①水 ②氢氧化钠溶液 ③汽油 ④食盐 ⑤乙醇 ⑥生石灰
乙组:A.结晶 B.蒸馏 C.萃取 D.分液 E.盐析 F.渗析 G.纸层析
| 编号 | 混合物 | 试剂序号 | 方法序号 |
| (1) | 分离溴水中的Br2 | ③ | C、B |
| (2) | 分离乙醇和水的混合液 | 、 | B |
| (3) | 除去乙醇中少量的水 | ⑥ | B |
| (4) | 除去淀粉溶液中的NaCl | ① | F |
| (5) | 除去硝酸钾中少量的氯化钾 | ① | A |
3.下列说法正确的是( )
| A. | 含铁元素质量分数为70%的Fe2O3是纯净物 | |
| B. | 溶液是电中性的,胶体是带电的 | |
| C. | 从颜色上可以区别FeCl3溶液和Fe(OH)3胶体 | |
| D. | 可以用过滤的方法来分离胶体粒子和溶液 |
20.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,4.48L水中含有的分子数为0.2NA | |
| B. | 1L 1mol•L-1 CaCl2溶液中含有的氯离子数为NA | |
| C. | 25℃,1.01×105Pa时,32gO2和O3的混合气体中含有的原子数为25NA | |
| D. | 在常温常压下,44gCO2中含有的原子数为3NA |
7.已知0.25mol CH4中所含原子数为a,则阿伏加德罗常数可表示为( )
| A. | $\frac{a}{5}$mol-1 | B. | 4amol-1 | C. | amol-1 | D. | $\frac{4}{5}$amol-1 |