题目内容
4.标准状况下,1体积水能可溶解V体积的NH3,所得溶液的密度为ag/cm3.(1)NH3的物质的量为多少mol?
(2)溶液的体积为多少L?
(3)NH3物质的量浓度是多少?(Mr(NH3)=17)要求:选择以上字母表达式计算,要求化简.
分析 (1)1体积水能可溶解V体积的NH3,则1L水中溶解了VL氨气,根据n=$\frac{V}{{V}_{m}}$计算出标准状况下V体积氨气的物质的量;
(2)根据m=nM计算出溶解的氨气的质量,1L水的质量为1000g,从而可得出所得溶液的质量,再根据V=$\frac{m}{ρ}$计算出所得溶液的体积;
(3)根据c=$\frac{n}{V}$计算出该溶液的物质的量浓度;
解答 解:(1)1体积水能可溶解V体积的NH3,则1L水中溶解了VL氨气,
标准状况下VL体积氨气的物质的量为:$\frac{VL}{22.4L/mol}$=$\frac{V}{22.4}$mol,
答:VL氨气的物质的量为$\frac{V}{22.4}$mol;
(2)$\frac{V}{22.4}$mol氨气的质量为:17g/mol×$\frac{V}{22.4}$mol=$\frac{17V}{22.4}$g,1L水的质量约为1000g,则所得溶液的质量为:1000g+=$\frac{17V}{22.4}$g,
则所得溶液的体积为:$\frac{1000g+\frac{17V}{22.4}g}{ag/c{m}^{3}}$=$\frac{22400+17V}{22.4a}$cm3=$\frac{22400+17V}{22.4a}$×10-3L,
答:所得溶液的体积为$\frac{22400+17V}{22.4a}$×10-3L;
(3)所得溶液的物质的量浓度为:$\frac{\frac{V}{22.4}mol}{\frac{22400+17V}{22.4a}×1{0}^{-3}L}$=$\frac{1000aV}{22400+17V}$mol/L,
答:所得溶液的浓度为=$\frac{1000aV}{22400+17V}$mol/L.
点评 本题考查了物质的量浓度的计算,题目难度中等,正确计算所得溶液体积为解答关键,注意熟练掌握物质的量浓度的概念及计算方法,试题培养了学生的分析能力及化学计算能力.

 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案| A. | X元素只能形成-种单质 | |
| B. | Y和M元素的最高正价相同 | |
| C. | M、N的最高价氧化物对应水化物的酸性强弱:M>N | |
| D. | Z与Y能形成Z2Y型的离子化合物 |
①它们所含的分子数目之比为1:1
②它们所含的O原子数目之比为1:2
③它们的体积之比为1:1
④它们所含的C原子数目之比为1:1
⑤它们所含的电子数目之比为7:11.
| A. | ①④⑤ | B. | ②③⑤ | C. | ①②④⑤ | D. | ①②③④⑤ |
| A. | 1:1 | B. | 1:3 | C. | 2:1 | D. | 1:4 |
| A. | NaF | B. | NaCl | C. | NaBr | D. | NaI |
| A. | 氮气的电子式: | |
| B. | 中子数是8的碳原子的符号:${\;}_{6}^{14}$C | |
| C. | Na的原子结构示意图: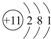 | |
| D. | 钙离子的电子式:Ca2+ |
| A. | K(g)═K+(g)+e- | B. | Cl(g)+e-═Cl(g) | C. | KCl(s)═K++Cl-(g) | D. | Cl2(g)═2Cl(g) |
| A. | c(X)=0.15mol•L-1 | B. | c(Y)=0.9mol•L-1 | C. | c(Z)=0.3mol•L-1 | D. | c(W)=0.6mol•L-1 |