题目内容
3.下列说法正确的是( )| A. | 含铁元素质量分数为70%的Fe2O3是纯净物 | |
| B. | 溶液是电中性的,胶体是带电的 | |
| C. | 从颜色上可以区别FeCl3溶液和Fe(OH)3胶体 | |
| D. | 可以用过滤的方法来分离胶体粒子和溶液 |
分析 A、纯净物是由一种物质组成的物质,混合物是由多种物质组成的物质;
B、溶液是电中性的,胶体也不带电;
C、氢氧化铁胶体和沉淀都是红褐色;
D、胶体和溶液都能透过滤纸;
解答 解:A、Fe2O3中铁元素的质量分数恰好为70%,Fe2O3属于纯净物,故A正确;
B、溶液是电中性的,胶体也不带电,但有些胶粒带电,有些不带电,故B错误;
C、氢氧化铁胶体和沉淀都是红褐色,单从颜色不能区分,故C错误;
D、胶体和溶液都能透过滤纸,所以不能用过滤的方法分离胶体和溶液,故D错误;
故选A.
点评 本题考查物质结构、性质、胶体的性质,题目难度不大,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
13.下列关于C2H4描述中,正确的是( )
| A. | 含有极性键和非极性键 | B. | 分子为直线形分子 | ||
| C. | 6个原子不在同一平面上 | D. | 有4个σ键和1个π键 |
14.X、Y、Z、M、N是元素周期表中的短周期主族元素.且原子序数依次增大.X原子最外层电子数是内层电子数的2倍,Y、M同主族且M的核电荷数是Y的2倍,Z原子半径在同周期主族元素原子中最大.下列相关说法正确的是( )
| A. | X元素只能形成-种单质 | |
| B. | Y和M元素的最高正价相同 | |
| C. | M、N的最高价氧化物对应水化物的酸性强弱:M>N | |
| D. | Z与Y能形成Z2Y型的离子化合物 |
11.已知意大利科学家曾合成了一种新型氧分子,它是由4个氧原子构成的,其分子式是O4;氯化氢的沸点是-85℃.标准状况下,甲、乙两容器中分别盛有氯化氢和O4,且它们所含的原子数相同,则甲、乙两容器的体积比是( )
| A. | 2:1 | B. | 1:1 | C. | 1:2 | D. | 1:3 |
18.设NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 常温常压下,48g O3含有的氧原子数为NA | |
| B. | 22g CO2所含的分子数为0.5NA | |
| C. | 11.5L CO2所含的分子数为0.5NA | |
| D. | 常温常压下,NA个Cl2分子所占有的体积为22.4L |
8.Point3以客观事实为依据建立起来的模型,在研究物质的结构和变化中有很重要的作用,如图表示乙烯(C2H4)、甲醛(HCHO)和A物质的分子结构模型,下列叙述错误的是( )
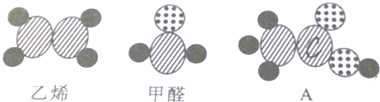

| A. | 物质A的分子式为C2H4O2 | |
| B. | 若A物质具有酸性,则乙烯和甲醛不一定具有酸性,若乙烯具有酸性,则A物质不一定具有酸性 | |
| C. | 若A物质是一元酸,则乙烯和甲醛不具有酸性 | |
| D. | 三种物质在空气中完全燃烧,生成的产物肯定不同 |
15.相等物质的量的CO和CO2相比较,下列有关叙述中正确的是( )
①它们所含的分子数目之比为1:1
②它们所含的O原子数目之比为1:2
③它们的体积之比为1:1
④它们所含的C原子数目之比为1:1
⑤它们所含的电子数目之比为7:11.
①它们所含的分子数目之比为1:1
②它们所含的O原子数目之比为1:2
③它们的体积之比为1:1
④它们所含的C原子数目之比为1:1
⑤它们所含的电子数目之比为7:11.
| A. | ①④⑤ | B. | ②③⑤ | C. | ①②④⑤ | D. | ①②③④⑤ |
12.将8mL N0和N02的混合气体充入一试管再倒立于水槽中,然后通人3mL氧气,反应完全后试管中气体全部消失,则原混合气体中N0和N02的体积比是( )
| A. | 1:1 | B. | 1:3 | C. | 2:1 | D. | 1:4 |
13.下列过程中,△H<0的是( )
| A. | K(g)═K+(g)+e- | B. | Cl(g)+e-═Cl(g) | C. | KCl(s)═K++Cl-(g) | D. | Cl2(g)═2Cl(g) |