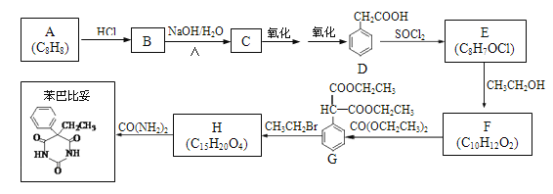
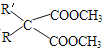
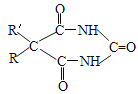
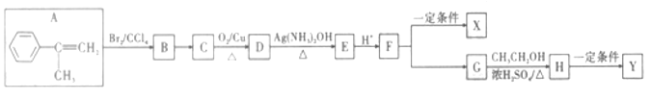
题目内容
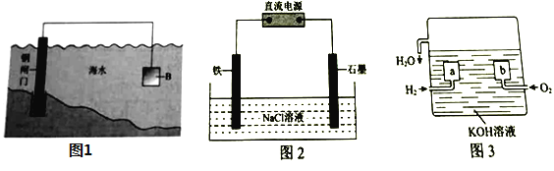
【题目】钢铁在海水中的锈蚀过程示意见图,有关说法正确的是
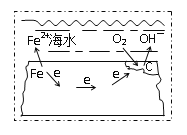
A.电子从碳转移给铁
B.在钢铁上连接铅块,可起到防护作用
C.正极反应为:O2 + 2H2O + 4e- =4OH-
D.钢管发生析氢腐蚀,负极反应是Fe—3e- =Fe3+
【答案】C
【解析】
钢铁在海水中生锈时发生电化学腐蚀,且主要以吸氧腐蚀为主,负极铁失电子变成二价铁离子Fe-2e- =Fe2+,正极上氧气得电子生成氢氧根离子,电极反应为:O2 + 2H2O + 4e- =4OH-;
A.由分析可知,铁为负极,碳为正极,电子由负极移动到正极,即由铁转移给碳,A项错误;
B.铁比铅活泼,在钢铁上连接铅块,形成的原电池中铁作负极,铅作正极,可使铁加速腐蚀,B项错误;
C.由分析可知,正极的电极反应为:O2 + 2H2O + 4e- =4OH-,C项正确;
D.由图可知空气中氧气逐渐减少,发生的不是析氢腐蚀而是吸氧腐蚀,负极的电极反应为:Fe-2e- =Fe2+,D项错误;
答案选C。

【题目】(1)2017年中科院某研究团队通过设计一种新型Na-Fe3O4/HZSM-5多功能复合催化剂,成功实现了CO2直接加氢制取辛烷值汽油,该研究成果被评价为“CO2催化转化领域的突破性进展”。
已知:H2(g)+1/2O2(g)=H2O(l) ΔH1 = -aKJ/mol
C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1) ΔH2= -bKJ/mol
试写出25℃、101kPa条件下,CO2与H2反应生成汽油(以C8H18表示)的热化学方程式_________________________________。
(2)利用CO2及H2为原料,在合适的催化剂(如Cu/ZnO催化剂)作用下,也可合成CH3OH,涉及的反应有:
甲:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H= — 53.7kJ·mol-1 平衡常数K1
CH3OH(g)+H2O(g) △H= — 53.7kJ·mol-1 平衡常数K1
乙:CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H= + 41.2kJ·mol-1 平衡常数K2
CO(g)+H2O(g) △H= + 41.2kJ·mol-1 平衡常数K2
①CO(g)+2H2(g) ![]() CH3OH(g)的平衡常数K=______(用含K1、K2的表达式表示),该反应△H_____0(填“大于”或“小于”)。
CH3OH(g)的平衡常数K=______(用含K1、K2的表达式表示),该反应△H_____0(填“大于”或“小于”)。
②提高CO2转化为CH3OH平衡转化率的措施有___________(填写两项)。
③催化剂和反应体系的关系就像锁和钥匙的关系一样,具有高度的选择性。下列四组实验,控制CO2和H2初始投料比均为1:2.2,经过相同反应时间(t1min)。
温度(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) | 综合选项 |
543 | Cu/ZnO纳米棒材料 | 12.3 | 42.3 | A |
543 | Cu/ZnO纳米片材料 | 11.9 | 72.7 | B |
553 | Cu/ZnO纳米棒材料 | 15.3 | 39.1 | C |
553 | Cu/ZnO纳米片材料 | 12.0 | 70.6 | D |
由表格中的数据可知,相同温度下不同的催化剂对CO2的转化为CH3OH的选择性有显著影响,根据上表所给数据结合反应原理,所得最优选项为___________(填字母符号)。
(3)以CO、H2为原料合成甲醇的反应为:CO(g)+2H2(g)![]() CH3OH(g)。在体积均为2L的三个恒容密闭容器Ⅰ、Ⅱ、Ⅲ中,分别都充入1molCO和2molH2,三个容器的反应温度分别为T1、T2、T3且恒定不变。下图为三个容器中的反应均进行到5min时H2的体积分数示意图,其中有一个容器反应一定达到平衡状态。
CH3OH(g)。在体积均为2L的三个恒容密闭容器Ⅰ、Ⅱ、Ⅲ中,分别都充入1molCO和2molH2,三个容器的反应温度分别为T1、T2、T3且恒定不变。下图为三个容器中的反应均进行到5min时H2的体积分数示意图,其中有一个容器反应一定达到平衡状态。
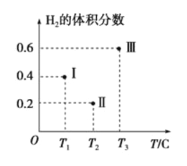
①0~5min时间内容器Ⅱ中用CH3OH表示的化学反应速率为_________________。
②三个容器中一定达到平衡状态的是容器________(填写容器代号)。