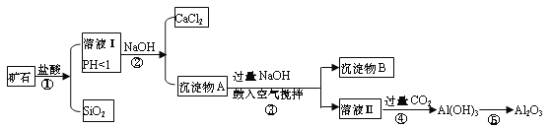
题目内容
【题目】I.已知C1O2是易溶于水难溶于有机溶剂的气体,常用于自来水消毒。实验室制备C1O2是用亚氯酸钠固体与氯气反应:2NaClO2+C12==2C1O2+2NaCl,装置如下图所示:
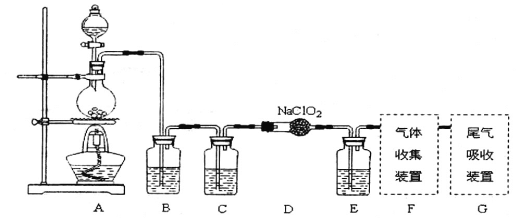
(1)烧瓶内可发生的反应的化学方程式:______________。
(2)B、C、E装置中的试剂依次为____________________
a、NaOH溶液 b、浓硫酸 c、饱和食盐水 d、CCl4 e、饱和石灰水
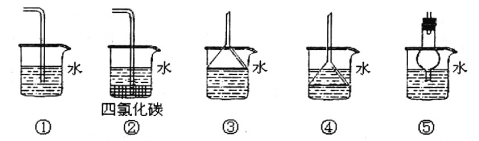
(3)以下装置既能吸收尾气又能防止倒吸的是_____________
II.用C1O2处理后的自来水中,C1O2的浓度应在0.10~0.80mg·L-1之间。用碘量法检测水中C1O2浓度的实验步骤如下:取100mCL的水样加稀硫酸调节pH至1~3,加入一定量的碘化钾溶液,振荡,再加入少量指示剂后,用1.0×10-4mol·L-1的Na2S2O3溶液滴定(己知:2S2O32-+I2==S4O62-+2I-)。
(4)加入的指示剂是___________,达到滴定终点时的现象是_________;
(5)碘化钾反应的离子方程式是________________。
(6)已知滴定终点时,消耗Na2S2O3溶液16.30mL,则水样中C1O2的浓度是___________mg·L-1。
【答案】MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2Oc b d②③⑤淀粉溶液,滴入最后一滴Na2S2O3溶液后,溶液的蓝色变为无色(或蓝色褪去),半分钟内不恢复原来的颜色。2ClO2 +8H++ 10I- = 2Cl- +4H2O +5I20.22
MnCl2+Cl2↑+2H2Oc b d②③⑤淀粉溶液,滴入最后一滴Na2S2O3溶液后,溶液的蓝色变为无色(或蓝色褪去),半分钟内不恢复原来的颜色。2ClO2 +8H++ 10I- = 2Cl- +4H2O +5I20.22
【解析】
(1)由实验装置图可见,烧瓶内制取氯气;(2)饱和食盐水可以吸收挥发出来的氯化氢气体,浓硫酸可以干燥氯气,CCl4可以吸收未参加反应的氯气;(3)ClO2是一种易溶于水的气体,尾气吸收时要防止倒吸,导气管不能插入到液面以下,装置①④可以引起倒吸,②③⑤既能吸收尾气又能防止倒吸;(4)淀粉溶液可以检验氧化生成的单质碘,达到滴定终点时的现象是滴入最后一滴Na2S2O3溶液后,溶液的蓝色变为无色(或蓝色褪去),半分钟内不恢复原来的颜色;(5)二氧化氯将碘离子氧化生成单质碘,根据得失电子和原子个数守恒书写和配平反应的离子方程式;(6)依据方程式得到物质间量的关系:ClO2——5S2O32-,在此基础上建立求解关系式求解。
I.(1)由实验装置图可见,烧瓶内制取氯气,发生的反应的化学方程式:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。(2)B装置用于吸收挥发出来的氯化氢气体,瓶内的试剂是c(饱和食盐水),C装置用于干燥氯气,瓶内的试剂是b(浓硫酸),E装置用于吸收未参加反应的氯气,试剂是d(CCl4)。(3)ClO2是一种易溶于水的气体,尾气吸收时要防止倒吸,导气管不能插入到液面以下,装置①④可以引起倒吸,②③⑤既能吸收尾气又能防止倒吸。II.(4)检验氧化生成的单质碘,加入的指示剂是淀粉溶液,达到滴定终点时的现象是滴入最后一滴Na2S2O3溶液后,溶液的蓝色变为无色(或蓝色褪去),半分钟内不恢复原来的颜色。(5)二氧化氯将碘离子氧化生成单质碘,根据得失电子平衡,反应的离子方程式是:2ClO2+8H++10I-=2Cl-+4H2O+5I2。(6)依据方程式2ClO2+8H++10I-=2Cl-+4H2O+5I2和2S2O32-+I2=S4O62-+2I-可得ClO2——5S2O32-,则有
MnCl2+Cl2↑+2H2O。(2)B装置用于吸收挥发出来的氯化氢气体,瓶内的试剂是c(饱和食盐水),C装置用于干燥氯气,瓶内的试剂是b(浓硫酸),E装置用于吸收未参加反应的氯气,试剂是d(CCl4)。(3)ClO2是一种易溶于水的气体,尾气吸收时要防止倒吸,导气管不能插入到液面以下,装置①④可以引起倒吸,②③⑤既能吸收尾气又能防止倒吸。II.(4)检验氧化生成的单质碘,加入的指示剂是淀粉溶液,达到滴定终点时的现象是滴入最后一滴Na2S2O3溶液后,溶液的蓝色变为无色(或蓝色褪去),半分钟内不恢复原来的颜色。(5)二氧化氯将碘离子氧化生成单质碘,根据得失电子平衡,反应的离子方程式是:2ClO2+8H++10I-=2Cl-+4H2O+5I2。(6)依据方程式2ClO2+8H++10I-=2Cl-+4H2O+5I2和2S2O32-+I2=S4O62-+2I-可得ClO2——5S2O32-,则有![]() =
=![]() ,解得x=3.26×10-4mmol,则水样中C1O2的浓度是3.26×10-4mmol×10×67.5=0.22mg·L-1。
,解得x=3.26×10-4mmol,则水样中C1O2的浓度是3.26×10-4mmol×10×67.5=0.22mg·L-1。

【题目】下列各组物质能满足如图所示转化关系的是(图中箭头表示进一步转化)
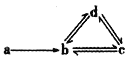
a | b | c | d | |
① | Si | SiO2 | H2SiO3 | Na2SiO3 |
② | Al | AlCl3 | NaAlO2 | Al(OH)3 |
③ | Cu | CuO | Cu(OH)2 | CuSO4 |
④ | Fe2O3 | FeCl3 | FeCl2 | Fe |
A. ①② B. ②③ C. ③④ D. ②④