题目内容
【题目】25℃时,用0.1000 mol·L-1KOH溶液滴定20.00 mL 0.1000 mol·L-1CH3COOH溶液,滴定中pH变化如图,下列关系错误的是
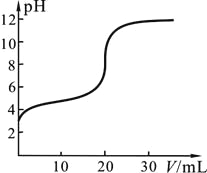
A. V=0.00mL时,CH3COOH溶液pH=3,其电离平衡常数K≈10-5mol·L-1
B. V=10.00mL时,溶液中c(CH3COO-)>c(K+)>c(H+)>c(OH-)
C. 溶液pH=7时,![]() =1
=1
D. V≥20.00mL时,溶液中c(K+)=c(CH3COO—)+c(OH-)+c(CH3COOH)
【答案】D
【解析】试题分析:A、0.1mol/L醋酸溶液的pH=3,则该温度下醋酸的电离常数为![]() ,A正确;B、V=10.00 mL时生成的醋酸钾的剩余的醋酸浓度相等,溶液显酸性,这说明醋酸的电离程度大于醋酸根的水解程度,则溶液中c(CH3COO-) >c(K+) >c(H+)>c(OH-),B正确;C、溶液pH=7时显中性,根据电荷守恒可知钾离子浓度等于醋酸根浓度,因此溶液中
,A正确;B、V=10.00 mL时生成的醋酸钾的剩余的醋酸浓度相等,溶液显酸性,这说明醋酸的电离程度大于醋酸根的水解程度,则溶液中c(CH3COO-) >c(K+) >c(H+)>c(OH-),B正确;C、溶液pH=7时显中性,根据电荷守恒可知钾离子浓度等于醋酸根浓度,因此溶液中![]() =1,C正确;D、V=20.00 mL时二者恰好反应生成醋酸钾,溶液中满足物料守恒c(K+)=c(CH3COO—)+c(CH3COOH),D错误,答案选D。
=1,C正确;D、V=20.00 mL时二者恰好反应生成醋酸钾,溶液中满足物料守恒c(K+)=c(CH3COO—)+c(CH3COOH),D错误,答案选D。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目