题目内容
11.下列混合物的含量测定分析,可用气体摩尔体积测定装置的是( )| A. | 食盐和沙子 | B. | 一氧化碳和二氧化碳 | ||
| C. | 铜锌合金 | D. | 氢氧化钠和氢氧化钙 |
分析 混合物的含量测定,可用气体摩尔体积测定完成的是利用混合物中一种成分和加入试剂反应生成气体在标准状况下得到物质的量,依据n=$\frac{m}{M}$计算得到质量,来计算其含量;
解答 解:A、食盐和沙子都是固体,测定成分需要溶解后称量固体质量得到沙子的质量,得到各成分含量,不需要测定气体体积,故A不符合;
B、一氧化碳和二氧化碳都是气体通过氢氧化钠溶液吸收二氧化碳,然后称量增重得到二氧化碳质量,计算成分含量,故B不符合;
C、铜锌合金放入稀硫酸溶液中溶解,利用测定生成的氢气体积测定锌的含量,故C符合;
D、氢氧化钠和氢氧化钙含量测定,利用溶液中复分解反应生成沉淀,称量沉淀质量,计算物质的量得到成分含量,故D不符合;
故选C.
点评 本题考查了气体摩尔体积的应用,主要是成分含量的测定实验过程分析应用,掌握基础是解题关键,题目较简单.

练习册系列答案
相关题目
4.生活中的下列现象,会发生化学变化的是( )
| A. | 寒冷的冬天玻璃窗上开出美丽的“窗花” | |
| B. | 石灰浆抹在墙上逐渐变硬 | |
| C. | 樟脑丸在衣柜中长期放置升华 | |
| D. | 闷热的夏天空调出风口飘散出“云雾” |
6.将等质量的钠分别投入质量和质量分数均为100g和98%的HCl,H2SO4,H3PO4溶液中,金属钠完全参加了反应.则生成的氢气在标准状况下的体积比是( )
| A. | 1:2:3 | B. | 3:2:1 | C. | 1:1:1 | D. | 无法计算 |
10.某化工厂利用氧化钴矿石制取CoC2O4(草酸钴)的工艺流程如下:(已知:黄钠铁矾不溶于水,可溶于酸)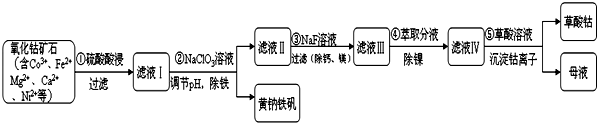
(1)步骤①中研究矿石粒度对钴浸出率的影响如表.从表中分析选择矿石粒度为-200目.
(2)步骤①需要用到的玻璃仪器,除烧杯外还有漏斗、玻璃棒.
(3)Ⅰ.步骤②中NaClO3将Fe2+氧化成Fe3+的离子方程式并标出电子转移方向和数目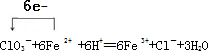 .
.
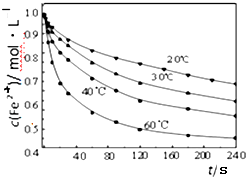
Ⅱ.探究温度对步骤②中NaClO3将Fe2+氧化成Fe3+的影响,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(Fe2+)的变化,结果如图,请从图中分析最合适的温度下,在0s 至120s内的平均反应速率v(Fe2+)=0.25 mol•L-1•min-1.
(4)请写出步骤 ③中除去镁离子的离子反应方程式Mg2++2F-=MgF2↓.
(5)若要检验黄钠铁矾[Na2 Fe6(SO4)4(OH)12]中含有的金属元素,请简述实验方案:取黄钠铁矾用盐酸溶液溶解,分成两份,一份做火焰色反应,火焰为黄色证明有Na+存在;另一份向其中滴加KSCN溶液,溶液变成血红色,证明有Fe3+存在.
(6)从绿色化学角度分析,母液中可循环利用的物质为硫酸(填写名称).

(1)步骤①中研究矿石粒度对钴浸出率的影响如表.从表中分析选择矿石粒度为-200目.
| 序号 | 矿石粒度/目 | 钴浸出率/% |
| 1 | -60 | 9.8 |
| 2 | -120 | 25.5 |
| 3 | -200 | 41.18 |
(3)Ⅰ.步骤②中NaClO3将Fe2+氧化成Fe3+的离子方程式并标出电子转移方向和数目
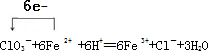 .
.Ⅱ.探究温度对步骤②中NaClO3将Fe2+氧化成Fe3+的影响,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(Fe2+)的变化,结果如图,请从图中分析最合适的温度下,在0s 至120s内的平均反应速率v(Fe2+)=0.25 mol•L-1•min-1.

(4)请写出步骤 ③中除去镁离子的离子反应方程式Mg2++2F-=MgF2↓.
(5)若要检验黄钠铁矾[Na2 Fe6(SO4)4(OH)12]中含有的金属元素,请简述实验方案:取黄钠铁矾用盐酸溶液溶解,分成两份,一份做火焰色反应,火焰为黄色证明有Na+存在;另一份向其中滴加KSCN溶液,溶液变成血红色,证明有Fe3+存在.
(6)从绿色化学角度分析,母液中可循环利用的物质为硫酸(填写名称).
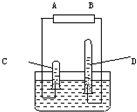 阿伏加德罗曾经总结出一条重要定律:同温同压下,同体积的任何气体含有相同数目的分子,右图是电解水的简易装置.
阿伏加德罗曾经总结出一条重要定律:同温同压下,同体积的任何气体含有相同数目的分子,右图是电解水的简易装置. 全溶解,所得溶液还能吸收0.56L氯气(STP),使其中的Fe2+全部转化为Fe3+。则该氧化物的化学式为( )
全溶解,所得溶液还能吸收0.56L氯气(STP),使其中的Fe2+全部转化为Fe3+。则该氧化物的化学式为( ) 反应速率偏高
反应速率偏高