题目内容
16.根据反应8NH3+3Cl2═6NH4Cl+N2,回答下列问题:(1)氧化剂是Cl2,还原剂是NH3;
(2)氧化剂和还原剂分子个数比为3:2;
(3)当有68g氨气参加反应时,被氧化的物质为17g,生成的还原产物为160.5g.
分析 反应3Cl2+8NH3=6NH4Cl+N2中,Cl元素化合价由0价降低到-1价,被还原,Cl2为氧化剂,N元素化合价由-3价升高到0价,被氧化,NH3为还原剂,结合元素化合价的变化和反应的方程式解答该题.
解答 解:(1)反应3Cl2+8NH3=6NH4Cl+N2中,Cl元素化合价由0价降低到-1价,被还原,Cl2为氧化剂,N元素化合价由-3价升高到0价,被氧化,NH3为还原剂,
故答案为:Cl2;NH3;
(2)由方程式可知,当有3molCl2参加反应时,有2molNH3被氧化,则氧化剂和还原剂的物质的量之比等于分子个数比,均为3:2,
故答案为:3:2;
(3)当有68g NH3参加反应时,n(NH3)=$\frac{68g}{17g/mol}$=4mol,其中有$\frac{1}{4}$的氨气被氧化,被氧化的氨气为4mol×$\frac{1}{4}$×17g/mol=17g,生成还原产物为NH4Cl,其质量为4mol×$\frac{6}{8}$×53.5g/mol=160.5g;
故答案为:17;160.5.
点评 本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化及物质的量关系为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
9.下面几种实验装置或操作正确的是( )
| A. |  制取并收集二氧化碳 | B. | 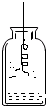 铁丝字氧气中燃烧 | ||
| C. |  加热高锰酸钾制氧气 | D. | 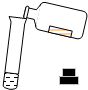 倾倒液体 |
8.某学生为了证明液化石油气中含有C、H元素,设计并完成了如下实验方案.请你帮助他完成下面的实验报告.
实验目的:证明液化石油气中含有C、H元素.
实验用品:火柴、储气瓶、光洁干燥小烧杯、澄清石灰水
实验目的:证明液化石油气中含有C、H元素.
实验用品:火柴、储气瓶、光洁干燥小烧杯、澄清石灰水
| 实验步骤 | 实验现象 | 结论 |
| (1)点燃液化石油气 (2)将光洁干燥的小烧杯罩在火焰上方 | 现象烧杯内壁有水雾 | 证明含有氢元素 |
| (3)将蘸有澄清石灰水的小烧杯罩在火焰上方 | 现象澄清石灰水变浑浊 | 证明含有碳元素 |
11.下列混合物的含量测定分析,可用气体摩尔体积测定装置的是( )
| A. | 食盐和沙子 | B. | 一氧化碳和二氧化碳 | ||
| C. | 铜锌合金 | D. | 氢氧化钠和氢氧化钙 |
为了提纯下列物质(括号中为杂质),所选除杂试剂和分离方法都正确的是( )
选项 | 被提纯的物质(杂质) | 除杂试剂 | 分离方法 |
A. | H2O(Br2) | CCl4 | 萃取分液 |
B. | MgCl2溶液(AlCl3) | 浓氨水 | 过滤 |
C. | CO2(HCl) | 饱和Na2CO3溶液 | 洗气 |
D. | Si(Al) | NaOH溶液 | 过滤 |
15. 实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择.化工行业的发展必须符合国家节能减排的总体要求.试运用所学知识,解决下列问题:
实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择.化工行业的发展必须符合国家节能减排的总体要求.试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为:K=$\frac{{C({H_2})C(CO)}}{{C({H_2}O)}}$,该条件下每消耗3g水蒸气,需吸收22kJ的热量,则该反应的热化学反应为:C(s)+H2O(g)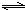 CO(g)+H2(g)△H=+132kJ/mol
CO(g)+H2(g)△H=+132kJ/mol
(2)已知在一定温度下,
C(s)+CO2(g)?2CO(g)平衡常数K1;
CO(g)+H2O(g)?H2(g)+CO2(g)平衡常数K2;
C(s)+H2O(g)?CO(g)+H2(g) 平衡常数K3;
则K1、K2、K3之间的关系是:K3=K1×K2.
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题.已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g)?H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
该反应的正反应方向是放热反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的起始浓度均为0.020mol/L,在该条件下,CO的平衡转化率为:75%.
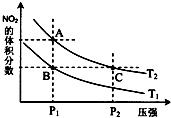
(4)从氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等.对反应N2O4(g)?2NO2(g)△H>0在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是D.
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法
E.A、C两点的化学平衡常数:A>C
(5)0.2mol/L的NaOH与0.4mol/L的硝酸铵溶液等体积混合后,溶液中各离子的物质的量浓度从大到小的顺序是c(NO3-)>c(NH4+)>c(Na+)>c(OH-)>c(H+).
 实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择.化工行业的发展必须符合国家节能减排的总体要求.试运用所学知识,解决下列问题:
实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择.化工行业的发展必须符合国家节能减排的总体要求.试运用所学知识,解决下列问题:(1)已知某反应的平衡表达式为:K=$\frac{{C({H_2})C(CO)}}{{C({H_2}O)}}$,该条件下每消耗3g水蒸气,需吸收22kJ的热量,则该反应的热化学反应为:C(s)+H2O(g)
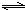 CO(g)+H2(g)△H=+132kJ/mol
CO(g)+H2(g)△H=+132kJ/mol(2)已知在一定温度下,
C(s)+CO2(g)?2CO(g)平衡常数K1;
CO(g)+H2O(g)?H2(g)+CO2(g)平衡常数K2;
C(s)+H2O(g)?CO(g)+H2(g) 平衡常数K3;
则K1、K2、K3之间的关系是:K3=K1×K2.
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题.已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g)?H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
(4)从氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等.对反应N2O4(g)?2NO2(g)△H>0在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是D.
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法
E.A、C两点的化学平衡常数:A>C
(5)0.2mol/L的NaOH与0.4mol/L的硝酸铵溶液等体积混合后,溶液中各离子的物质的量浓度从大到小的顺序是c(NO3-)>c(NH4+)>c(Na+)>c(OH-)>c(H+).
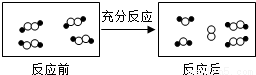
 和
和 代表不同元素的原子。
代表不同元素的原子。