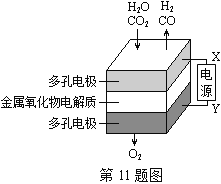
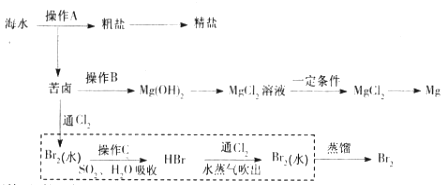
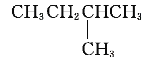题目内容
【题目】对利用甲烷消除NO2污染进行研究,CH4+2NO2![]() N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见下表。下列说法正确的是( )
N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见下表。下列说法正确的是( )

A. 由实验数据可知实验控制的温度T2>T1
B. 组别①中,0-20min内,NO2的降解速率为0.0125mol·L-1·min-1
C. 40min时,表格中T2对应的数据为0.18
D. 0~10min内,CH4的降解速率:①>②
【答案】A
【解析】
A、温度越高反应速率越大,达平衡所需要越短,由实验数据可知实验控制的温度T2>T1,选项A正确;B、随着反应的进行,反应物的浓度降低,反应速率减小,故组别①中,0-20min内,NO2的降解速率为0.0125mol·L-1·min-1,选项B错误;C、40min时,表格中T2对应的数据为0.15-0.18之间,选项C错误;D、0~10min内,CH4的降解速率:②>①,选项D错误。答案选B。

【题目】(1)在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-。两步反应的能量变化如图所示。
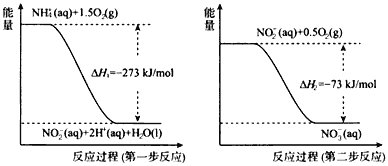
①第一步反应是____(填“放热”或“吸热”)反应。
②1molNH4+(aq)全部氧化成NO3-(aq)的热化学方程式是______。
(2)已知,H2(g)+Br2(l)=2HBr (g) △H=-72kJ/mol,蒸发1molBr2(l)需要吸收的能量为30kJ,其它相关数据如下表:
物质 | H2(g) | Br2(g) | HBr (g) |
1mol分子中的化学键断裂时需要吸收的能量/kJ | 436 | a | 369 |
则表中a为_____。
(3)研究NO2、SO2 、CO等大气污染气体的处理方法具有重要的意义。
已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH= -196.6 kJ·mol-1
2SO3(g) ΔH= -196.6 kJ·mol-1
2NO(g)+O2(g)![]() 2NO2(g) ΔH= -113.0 kJ·mol-1
2NO2(g) ΔH= -113.0 kJ·mol-1
则反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)的ΔH=____kJ·mol-1;
SO3(g)+NO(g)的ΔH=____kJ·mol-1;