题目内容
【题目】海水是巨大的资源宝库。下图是人类从海水资源获取某些重要化工原料的流程示意图。
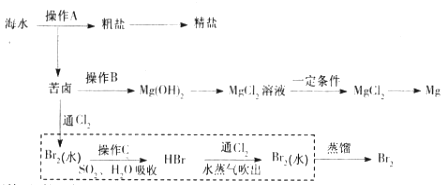
回答下列问题:
(1)操作A是_______________(填实验基本操作名称)。要知道海水晒盐的过程中溶液里食盐含量在逐渐提高的简易方法是__________________。
a.分析氯化钠含量 b.测定溶液密度 c.观察是否有沉淀析出
(2)操作B需加入下列试剂中的一种,最合适的是_____________。
a.氢氧化钠溶液 b.澄清石灰水 c.石灰乳d.碳酸钠溶液
(3)上图中虚线框内流程的主要作用是_____________。写出溴水中通入SO2时反应的离子方程式____________
(4)上图中虚线框内流程也可用![]() Br2与Na2CO3反应的化学方程式补充完整:
Br2与Na2CO3反应的化学方程式补充完整:
![]() ___________
___________
(5)已知苦卤的主要成分如下:

理论上,1 L苦卤最多可得到Mg(OH)2的质量为________g。
【答案】蒸发结晶(过滤)bc富集Br2Br2+SO2+2H2O=4H++SO42-+2Br-3Br2+3Na2CO3=NaBrO3+5NaBr+3CO269.6
【解析】
海水晒盐过滤得到苦卤和粗盐,粗盐精制得到饱和食盐水,苦卤中加入石灰乳沉淀镁离子形成氢氧化镁沉淀,过滤得到氢氧化镁沉淀中加入盐酸溶解得到氯化镁溶液,蒸发浓缩,冷却结晶得到氯化镁晶体,在氯化氢气流中加热得到氯化镁,电解熔融氯化镁得到金属镁;苦卤中通入氯气氧化溴离子为单质溴,用二氧化硫水溶液吸收溴单质,得到HBr,再通入氯气氧化溴化氢得到溴单质,富集溴元素,用水蒸气吹出蒸馏得到液溴。
(1)对于溶解度受温度影响大的物质可以通过降温结晶的方法得到晶体,对溶解度受温度影响小的物质可以通过蒸发结晶的方法得到晶体;(2)根据工业制镁的原理从原料的成本以及性质、工业生产的经济效益等来分析;(3)氯气氧化溴离子得到单质溴,溴易挥发,热空气可以吹出生成的溴单质,根据起初有溴最终也有溴,考虑物质的富集;(4)氯化钠、氯化镁的富集Br2与Na2CO3反应生成NaBrO3、NaBr和CO2,根据得失电子守恒和原子守恒配平方程式;(5)根据化学方程式的计算。
(1)海水得到粗盐的操作是蒸发结晶、过滤;盐水的浓度越大密度越大,要知道海水晒盐的过程中溶液里食盐含量在逐渐提高的简易方法是测定溶液密度,答案选b;
(2)苦卤获得氢氧化镁固体,需加入碱溶液,氢氧化钠价格高、石灰水的浓度小,最合适的是石灰乳,答案选c;
(3)上图中虚线框内是提取溴,上图中虚线框内流程的主要作用是富集Br2;溴水中通入SO2时反应的离子方程式Br2+SO2+2H2O=4H++SO42-+2Br-;
(4)Br2与Na2CO3反应生成NaBrO3、NaBr和CO2,Br元素部分由0价升高到+5价,另一部分从0价降低到-1价,则生成的NaBrO3与NaBr的物质的量之比为1:5,所以配平方程式为:3Br2+3Na2CO3=NaBrO3+5NaBr+3CO2;
(5)Mg2+→Mg(OH)2
24 58
28.8 X
解得X=69.6g。

【题目】苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是:C8H10(g)C8H8(g)+H2(g)△H=120kJ·mol-1某温度下,将0.40mol苯乙烷,充入2L真空密闭容器中发生反应,测定不同时间该容器内气体物质的量,得到数据如下表:
时间/min | 0 | 10 | 20 | 30 | 40 |
n(C8H10)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
n(C8H8)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
(1)当反应进行到20min时,该段时间内H2的平均反应速率是_____________。
(2)该温度下,该反应的化学平衡常数是_______________________。
(3)若保持其他条件不变,用0.40 molH2(g)和0.40molC8H8(g)合成C8H10(g),当有30kJ热量放出时,该反应中H2的转化率是__________。此时,该合成反应是否达到了平衡状态?_______(填“是”或“否”)。
(4)工业上以高温水蒸气作为反应体系的稀释剂(不参与反应),C8H10(g)的平衡转化率与水蒸气的用量、体系的温度、压强的关系如图Ⅰ、图Ⅱ所示。

①由图Ⅰ可知,T1________T2(填“大于”、“小于”或“等于”)。
②由图Ⅱ可知,当其他条件不变时,水蒸气的用量越大,C8H10的平衡转化率将________(填“越大”、“越小”或“不变”),原因是______________________________________。


