题目内容
2.某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合液,经测定ClO -与ClO3-的离子个数比为3:1,则Cl2与NaOH反应时被还原的氯原子与被氧化的氯原子的个数比为( )| A. | 21:5 | B. | 2:1 | C. | 4:1 | D. | 11:3 |
分析 Cl2被氧化生成ClO-与ClO3-,Cl2还原有生成NaCl,ClO -与ClO3-的离子个数比为3:1,假设ClO -与ClO3-的物质的量分别为3mol、1mol,根据电子转移守恒计算ClO-的物质的量,再根据Cl原子守恒计算被还原的氯原子与被氧化的氯原子的个数比.
解答 解:Cl2被氧化生成ClO-与ClO3-,Cl2还原有生成NaCl,ClO -与ClO3-的离子个数比为3:1,假设ClO -与ClO3-的物质的量分别为3mol、1mol,根据电子转移守恒,ClO-的物质的量=$\frac{3mol×1+1mol×5}{1}$=8mol,根据Cl原子守恒,被还原的氯原子与被氧化的氯原子的个数比=8mol:(3mol+1mol)=2:1,
故选:B.
点评 本题考查氧化还原反应的计算,题目难度不大,注意守恒法的利用.

练习册系列答案
相关题目
12.将下列各组物质按单质、氧化物、酸、碱、盐分类顺序排列,其中正确的是( )
| A. | 镁、干冰、硫酸、纯碱、食盐 | B. | 碘酒、冰、盐酸、烧碱、硫酸钡 | ||
| C. | 氢气、氧化钠、硝酸、烧碱、氯化铜 | D. | 铁、氧化铜、醋酸、石灰水、硝酸钾 |
13.下列离子方程式中正确的是( )
| A. | 盐酸滴在石灰石上:CO32-+2H+═H2O+CO2↑ | |
| B. | 少量CO2通入氢氧化钠溶液中:CO2+2OH-═CO32-+H2O | |
| C. | NaOH溶液和NaHSO4溶液反应:HSO4-+OH-═SO42-+H2O | |
| D. | 稀H2SO4滴在铜片上:Cu+2H+═Cu2++H2↑ |
10.以下说法正确的是( )
| A. | 加入FeCl3溶液显紫色,说明存在酚羟基 | |
| B. | 加入金属钠能放出氢气,说明存在羧基 | |
| C. | 能使酸性高锰酸钾溶液褪色,说明存在碳碳双键 | |
| D. | 在2mL 2%的CuSO4溶液中加入10%的NaOH溶液4~5滴配制成氢氧化铜悬浊液,用以检验醛基 |
17.在三个密闭容器中分别充入CH4、H2、HCl三种气体,当它们的温度和压强都相同时,这三种气体的密度,从大到小的顺序是( )
| A. | CH4>H2>HCl | B. | CH4>N2>HCl | C. | H2>HCl>CH4 | D. | HCl>CH4>H2 |
7.NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 常温常压下,0.05 NA个CO2分子所占的体积是1.12 L | |
| B. | 把200 mL 1.5 mol•L-1的BaCl2溶液跟100 mL 3 mol•L-1的KCl溶液混合后,溶液中的c(Cl-)仍然是3 mol•L-1(忽略混合后溶液体积的变化) | |
| C. | 常温常压下,32 g氧气和32 g H2S分子个数比为1:1 | |
| D. | 标准状况下,NA个水分子所占的体积为22.4 L |
11.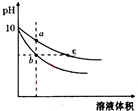 常温下,相同pH的氢氧化钠和醋酸钠溶液加水稀释,平衡时pH随溶液体积变化的曲线如图所示,则下列说法正确的是( )
常温下,相同pH的氢氧化钠和醋酸钠溶液加水稀释,平衡时pH随溶液体积变化的曲线如图所示,则下列说法正确的是( )
 常温下,相同pH的氢氧化钠和醋酸钠溶液加水稀释,平衡时pH随溶液体积变化的曲线如图所示,则下列说法正确的是( )
常温下,相同pH的氢氧化钠和醋酸钠溶液加水稀释,平衡时pH随溶液体积变化的曲线如图所示,则下列说法正确的是( )| A. | b、c两点溶液的导电能力相同 | |
| B. | 稀释之前,两溶液导电能力相同 | |
| C. | a、b、c三点溶液中水的电离程度c>a>b | |
| D. | 用相同浓度的盐酸分别与等体积的b、c处溶液反应,消耗盐酸体积Vc>Vb |
12.t℃时,将a g NH3完全溶解于水,得V mL饱和溶液,测得该溶液的密度为ρg/cm3(ρ<1),溶质的质量分数为w,且其中n(NH${\;}_{4}^{+}$)为bmol.下列叙述中错误的是( )
| A. | 溶液中c(OH-)=$\frac{1000b+c(H+)V}{V}$ mol/L | |
| B. | 溶质的物质的量浓度c=$\frac{1000a}{17V}$ mol/L | |
| C. | 溶质的质量分数w=$\frac{a}{ρV-a}$×100% | |
| D. | 向上述溶液中再加入VmL水后,所得溶液中溶质的质量分数小于0.5w |