题目内容
14.二氧化硫是形成酸雨的“罪魁祸首”,为了保护环境,应减少SO2在大气中的排放.请回答下列问题:(1)SO2与水反应可生成亚硫酸,那么SO2是②(填序号:①电解质②非电解质).
(2)工业尾气中的SO2常用NaOH溶液吸收,生成Na2SO3或NaHSO3,写出生成NaHSO3的离子方程式SO2+OH-=HSO3-.
(3)SO2在催化剂的作用下可被氧气氧化成SO3,SO3与水反应生成H2SO4,写出H2SO4与Ba(OH)2反应的离子方程式2H++2OH-+SO42-+Ba2+=BaSO4↓+2H2O.
分析 (1)电解质必须本身能够电离产生自由移动离子;
(2)二氧化硫与少量氢氧化钠反应生成亚硫酸氢钠;
(3)H2SO4与Ba(OH)2反应生成硫酸钡和水.
解答 解:(1)二氧化硫是化合物,但是本身不能电离出自由离子,属于非电解质,故选:②;
(2)二氧化硫与少量氢氧化钠反应生成亚硫酸氢钠,离子方程式:SO2+OH-=HSO3-,故答案为:SO2+OH-=HSO3-;
(3)H2SO4与Ba(OH)2反应生成硫酸钡和水,离子方程式:2H++2OH-+SO42-+Ba2+=BaSO4↓+2H2O,故答案为:2H++2OH-+SO42-+Ba2+=BaSO4↓+2H2O.
点评 本题考查了硫及其化合物性质,侧重考查离子方程式、化学方程式书写,明确二氧化硫的性质是解题关键,注意电解质必须本身能够电离,题目难度不大.

练习册系列答案
相关题目
4.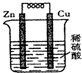 关于如图所示的原电池,下列说法不正确的是( )
关于如图所示的原电池,下列说法不正确的是( )
 关于如图所示的原电池,下列说法不正确的是( )
关于如图所示的原电池,下列说法不正确的是( )| A. | 铜片为正极,锌片为负极 | B. | 锌片溶解,质量减少 | ||
| C. | 该装置将化学能转化为电能 | D. | 电子由铜片经导线流向锌片 |
5.下列物质所属类别不正确的是( )
| A. | 氯化铝--盐 | B. | 纯碱--碱 | C. | 金属钠--单质 | D. | 胆矾--纯净物 |
2.某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合液,经测定ClO -与ClO3-的离子个数比为3:1,则Cl2与NaOH反应时被还原的氯原子与被氧化的氯原子的个数比为( )
| A. | 21:5 | B. | 2:1 | C. | 4:1 | D. | 11:3 |
9.在标准状况下,下列四种气体的关系中,从大到小的是( )
①6.72L CH4 ②3.01×1023个HCl分子③13.6g H2S ④0.2mol NH3.
①6.72L CH4 ②3.01×1023个HCl分子③13.6g H2S ④0.2mol NH3.
| A. | 体积:④>①>②>③ | B. | 密度:②>③>④>① | ||
| C. | 质量:②>③>①>④ | D. | 氢原子数:①>②>③>④ |
19.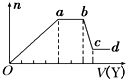 某无色稀溶液X中,可能含有如表所列离子中的某几种.
某无色稀溶液X中,可能含有如表所列离子中的某几种.
取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(V)的关系如图所示.下列说法正确的是( )
 某无色稀溶液X中,可能含有如表所列离子中的某几种.
某无色稀溶液X中,可能含有如表所列离子中的某几种.| 阴离子 | CO${\;}_{3}^{2-}$、SiO${\;}_{3}^{2-}$、AlO${\;}_{3}^{-}$、Cl- |
| 阳离子 | Al3+、Fe3+、Mg2+、NH${\;}_{4}^{+}$、Na+ |
| A. | 若Y是盐酸,则X中一定含有CO${\;}_{3}^{2-}$、SiO${\;}_{3}^{2-}$、AlO${\;}_{2}^{-}$和NH${\;}_{4}^{+}$ | |
| B. | 若Y是NaOH溶液,则X中一定含有Al3+、Fe3+、NH${\;}_{4}^{+}$、Cl- | |
| C. | 若Y是NaOH溶液,则ab段发生反应的离子方程式为:NH${\;}_{4}^{+}$+OH-=NH3↑+H2O | |
| D. | 若Y是NaOH溶液,则X中的Al3+、Mg2+、NH${\;}_{4}^{+}$物质的量之比为2:1:4 |
6.下列有关物质用途的叙述错误的是( )
| A. | 氯气可用于自来水消毒 | |
| B. | 40%的甲醛水溶液可用作防腐剂,浸制生物标本 | |
| C. | 工业酒精可用于酿造饮用酒 | |
| D. | 煤的气化和液化主要是生成清洁燃料,煤的干馏主要是生产化工原料 |
3.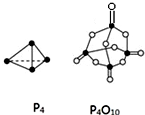 参考如表键能数据和相关物质结构模型,估算热化学方程式:Si(s)+O2(g)═SiO2(s)、P4(s,白磷)+5O2(g)═P4O10(s)中,△H的值分别为( )
参考如表键能数据和相关物质结构模型,估算热化学方程式:Si(s)+O2(g)═SiO2(s)、P4(s,白磷)+5O2(g)═P4O10(s)中,△H的值分别为( )
 参考如表键能数据和相关物质结构模型,估算热化学方程式:Si(s)+O2(g)═SiO2(s)、P4(s,白磷)+5O2(g)═P4O10(s)中,△H的值分别为( )
参考如表键能数据和相关物质结构模型,估算热化学方程式:Si(s)+O2(g)═SiO2(s)、P4(s,白磷)+5O2(g)═P4O10(s)中,△H的值分别为( )| 化学键 | Si-O | O=O | Si-Si | P-P | P-O | P=O | O=O |
| 键能kJ•mol-1 | 460 | 498.8 | 176 | a | b | c | d |
| A. | -61.2 kJ•mol-1、(4c+12b-4a-5d)kJ•mol-1 | |
| B. | -989.2 kJ•mol-1、(4c+12b-6a-5d)kJ•mol-1 | |
| C. | -989.2 kJ•mol-1、(6a+5d-4c-12b)kJ•mol-1 | |
| D. | -245.2 kJ•mol-1、(4a+5d-4c-12b)kJ•mol-1 |

 .
. .
. 2CH3CHO+2H2O.
2CH3CHO+2H2O. .
.