题目内容
【题目】(1)15.6gNa2X固体中含有0.4molNa+,则该化合物的摩尔质量为______,将这些Na2X固体溶解到水中,并加水稀释至2L,则所得溶液中Na+的物质的量浓度为____ mol·L-1。
(2)电解饱和食盐水的化学方程式为___________,若时消耗117gNaCl,则理论上最多可得到_____ L(标准状况)氯气。
(3)若将2mol氯气通入足量石灰乳中,理论上可得到次氯酸钙________克?(写出具体计算过程)
【答案】78g/mol 0.2 2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑ 22.4 143
2NaOH+H2↑+Cl2↑ 22.4 143
【解析】
(1)根据化合物Na2X的构成由Na+的物质的量确定Na2X的物质的量,然后根据n=![]() 确定Na2X的摩尔质量,结合c=
确定Na2X的摩尔质量,结合c=![]() 计算c(Na+);
计算c(Na+);
(2)电解饱和NaCl溶液制取Cl2,根据方程式中的物质的量关系计算反应产生的Cl2在标准状况下的体积;
(3)根据Cl2与石灰乳反应可计算出反应制取的次氯酸钙的质量。
(1)15.6gNa2X固体中含有0.4molNa+,则n(Na2X)=![]() n(Na+)=
n(Na+)=![]() ×0.4mol=0.2mol,则M=
×0.4mol=0.2mol,则M=![]() =78g/mol;将这些Na2X固体溶解到水中,并加水稀释至2L,则所得溶液中Na+的物质的量浓度c=
=78g/mol;将这些Na2X固体溶解到水中,并加水稀释至2L,则所得溶液中Na+的物质的量浓度c=![]() =0.2mol/L,故合理答案为:78g/mol;0.2;
=0.2mol/L,故合理答案为:78g/mol;0.2;
(2)电解饱和NaCl溶液制取Cl2,反应方程式为:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,根据方程式可知2molNaCl反应,产生1molCl2,n(NaCl)=
2NaOH+H2↑+Cl2↑,根据方程式可知2molNaCl反应,产生1molCl2,n(NaCl)=![]() =2mol,则n(Cl2)=1mol,其在标准状况下的体积V(Cl2)=1mol×22.4L/mol=22.4L故合理答案为:2NaCl+2H2O
=2mol,则n(Cl2)=1mol,其在标准状况下的体积V(Cl2)=1mol×22.4L/mol=22.4L故合理答案为:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑;22.4;
2NaOH+H2↑+Cl2↑;22.4;
(3)Cl2与石灰乳发生反应:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,根据反应方程式可知n[Ca(ClO)2]=![]() n(Cl2)=
n(Cl2)=![]() ×2mol=1mol,则反应产生的Ca(ClO)2的质量m[Ca(ClO)2]=1mol×143g/mol=143g,故合理答案为:143。
×2mol=1mol,则反应产生的Ca(ClO)2的质量m[Ca(ClO)2]=1mol×143g/mol=143g,故合理答案为:143。

【题目】硫代硫酸钠晶体(![]() ,
,![]() )可用作还原剂。回答下列问题:
)可用作还原剂。回答下列问题:
(1)已知:![]() ,
,![]() 都是难溶于水的固体。市售硫代硫酸钠中常含有硫酸根杂质,选用下列试剂设计实验方案进行检验:
都是难溶于水的固体。市售硫代硫酸钠中常含有硫酸根杂质,选用下列试剂设计实验方案进行检验:
试剂:稀盐酸、稀![]() 、
、![]() 溶液、
溶液、![]() 溶液、
溶液、![]() 溶液
溶液
实验步骤 | 现象 |
①取少量样品,加入除氧蒸馏水 | ②固体完全溶解得无色澄清溶液 |
③取少量溶液溶于盐酸 | ④出现乳黄色浑浊,_____ |
⑤静置,________ | ⑥_______ |
(2)利用![]() 作为标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下:
作为标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下:
①溶液配制;称取1.270g纯净的![]() ,在盛有KI溶液的____(填仪器名称,下同)中溶解(反应为
,在盛有KI溶液的____(填仪器名称,下同)中溶解(反应为![]() ,
,![]() 能够充分反应),完全溶解后,全部转移至100 mL的____中,加蒸馏水至刻度线,此时
能够充分反应),完全溶解后,全部转移至100 mL的____中,加蒸馏水至刻度线,此时![]() 溶液的物质的量浓度为____
溶液的物质的量浓度为____![]() ;再取
;再取![]() 样品配制成溶液,备用。
样品配制成溶液,备用。
②滴定:利用发生反应:![]() ,对上述配制的
,对上述配制的![]() 溶液进行滴定,终点时消耗标准溶液20.00 mL,则样品纯度为___%(保留1位小数。
溶液进行滴定,终点时消耗标准溶液20.00 mL,则样品纯度为___%(保留1位小数。
【题目】下表是A、B、C、D四种有机物的有关信息:
A | ①能使溴的四氯化碳溶液褪色; ②能与水在一定条件下反应生成C; ③比例模型为: |
B | ①由C、H两种元素组成; ②球棍模型为: |
C | ①由C、H、O三种元素组成; ②能与Na反应,但不能与NaOH溶液反应; ③与二甲醚互为同分异构体。 |
D | ①相对分子质量比C物质少2; ②能由物质C氧化而成。 |
根据表中信息回答下列问题:
(1)A与溴的四氯化碳溶液反应的生成物的名称为___________(系统命名法);写出该生成物与足量的NaOH水溶液共热的化学方程式___________。
(2)A与氢气发生加成反应后生成分子F,与F在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2。当n=________时,这类有机物开始出现同分异构体。
(3)B具有的性质是________(填序号):①无色无味液体、②有毒、③不溶于水、④密度比水大、⑤高锰酸钾酸性溶液和溴水反应褪色、⑥任何条件下不与氢气反应;写出在浓硫酸作用下,B与浓硝酸反应的化学方程式为: _______
(4)写出由C氧化生成D的化学方程式________。
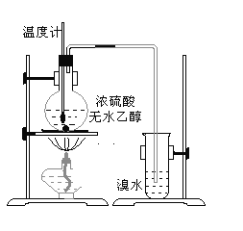
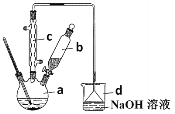
【题目】溴苯是一种化工原料,实验室合成溴苯装置图及有关数据如下:
项目 | 苯 | 溴 | 溴苯 |
密度/(g·cm-3) | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
(1)在a中加入15mL无水苯和少量铁屑,在b中小心加入4.0mL液态溴。仪器c的名称是____________,其进水口为_____(填“上”或“下”)口,装置d中倒置漏斗作用为________。
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤。NaOH溶液洗涤的作用是_______。
③向分出的粗溴苯中加入少量的无水硫酸镁,静置、过滤。
(3)经以上分离操作后,要进一步提纯,下列操作中必需的是____(填入正确选项前的字母):
A.重结晶 B.过滤 C.蒸馏 D.萃取
(4)将d中的NaOH溶液换成硝酸银溶液,则出现的现象为_____________,该现象_____(填“能”或“不能”)说明该反应为取代反应。
解决(3)时用到题干中的哪些信息_______