题目内容
【题目】(1)在400℃时,将一定量的SO2和14molO2压入一个盛有催化剂的10L密闭容器中进行反应:2SO2+O2![]() 2SO3,已知2min后,容器中剩余2molSO2和12molO2,则:
2SO3,已知2min后,容器中剩余2molSO2和12molO2,则:
①生成了__molSO3,SO2的起始物质的量浓度是__。
②2min内平均反应速率:v(O2)=__。
(2)某温度时,在2 L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示。
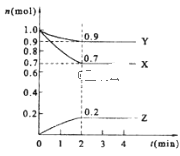
①X的转化率是__;
②由图中所给数据进行分析,该反应的化学方程式为___;
③若三种物质都是气体,则平衡时Y所占体积的百分比为__。
【答案】4 0.6mol/L 0.1mol/(Lmin) 30% 3X+Y2Z 50%
【解析】
(1)①设开始时加入SO2的物质的量为x mol,根据已知信息可列出三段式计算生成SO3物质的量以及SO2的起始物质的量浓度;
②依据公式![]() 计算反应速率;
计算反应速率;
(2)①根据![]() 计算X的转化率;
计算X的转化率;
②根据物质的量的变化判断X、Y为反应物,Z为生成物,再根据物质的量的变化之比等于化学计量数之比书写方程式;
③根据物质的量分数等于体积分数计算Y所占体积的百分比。
(1)①设开始时加入SO2的物质的量为x mol,则可列出三段式,
2SO2+O2![]() 2SO3
2SO3
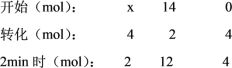
则 x-4=2,解得,x=6mol,则开始时加入SO2的物质的量为6 mol,SO2的起始物质的量浓度是![]() ,生成了4 molSO3;
,生成了4 molSO3;
故答案为:4;0.6mol/L;
②2min内平均反应速率:![]() ;
;
故答案为:0.1mol/(Lmin);
(2)①由图象可知,从反应开始到平衡,X的物质的量从1mol变为0.7mol,则X转化率为![]() ;
;
故答案为:30%;
②由图象可以看出,反应中X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成物,且△n(X):△n(Y):△n(Z)=0.3mol:0.1mol:0.2mol=3:1:2,则反应的化学方程式为3X+Y2Z;
故答案为:3X+Y2Z;
③平衡时,X为0.7mol,Y为0.9mol,Z为0.2mol,若三种物质都是气体,则平衡时Y所占体积的百分比为![]() ;
;
故答案为:50%。

 习题精选系列答案
习题精选系列答案