��Ŀ����
����Ŀ���״���һ�ֿ�������Դ���ɶ�����̼�Ʊ��״��Ĺ��̿����漰�ķ�Ӧ���£�
��Ӧ��CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ��H1=-49.58kJ��mol-1
CH3OH(g)+H2O(g) ��H1=-49.58kJ��mol-1
��Ӧ��CO2(g)+H2(g)![]() CO(g)+H2O(g) ��H2
CO(g)+H2O(g) ��H2
��Ӧ��CO(g)+2H2(g)![]() CH3OH(g) ��H3=-90.77kJ��mol-1
CH3OH(g) ��H3=-90.77kJ��mol-1
�ش��������⣺
��1����Ӧ��ġ�H2=_________________��
��2����Ӧ���ܹ��Է����е�������_______________ (�����ϵ��¶��� ���ϸ��¶��������κ��¶��� )��
��3�����£������ܱ������У����ڷ�Ӧ������˵������˵���÷�Ӧ�ﵽ��ѧƽ��״̬����______��
A�����������ܶȲ��ٱ仯
B����������ƽ����Է����������ٱ仯
C��CO2��H2��CH3OH��H2O�����ʵ���֮��Ϊ1��3��1��1
D���״��İٷֺ������ٱ仯
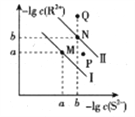
��4�����ڷ�Ӧ��ͬ�¶ȶ�CO2��ת���ʼ�������Ч��Ӱ����ͼ��ʾ�������й�˵������ȷ����__________��
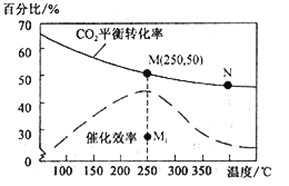
A�������������䣬����ʹ�ô�������250��ʱCO2��ƽ��ת���ʿ���λ��M1
B���¶ȵ���250 ��ʱ�����¶����״��IJ�������
C��M ��ʱƽ�ⳣ����N��ʱƽ�ⳣ����
D��ʵ�ʷ�ӦӦ�������ڽϵ͵��¶��½��У������CO2��ת����
��5����֪����������20���µ�Ksp���£��Իش��������⣺
��� | �� | �� | �� | �� | �� |
��ѧʽ | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
��ɫ | ��ɫ | dz��ɫ | ��ɫ | ��ɫ | ��ɫ |
Ksp | 1.8��10-10 | 5.4��10-13 | 8.3��10-17 | 6.3��10-50 | 2.0��10-12 |
��20��ʱ�������������α�����Һ�У�Ag+���ʵ���Ũ���ɴ�С��˳���ǣ����ţ�____________��
����BaCl2��Һ�м���AgNO3��KBr�������ֳ�������ʱc(Br-)/c(Cl-)=________________��
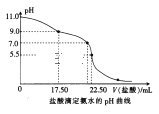
�� �ⶨˮ�����Ȼ���ĺ��������ñ������������еζ����ζ�ʱ��Ӧ�����ָʾ����____��
A.KBr B��KI C��K2S D��K2CrO4
��6����֪25��ʱKsp[Mg(OH)2]=5.6��10-12��Ksp[Cu(OH)2]=2.2��10-20��Ksp[Fe(OH)3]=4.0��10-38��Ksp[Al(OH)3]=1.1��10-33��
����25���£���Ũ�Ⱦ�Ϊ0.1 mol��L-1��AlCl3��CuCl2�����Һ����μ��백ˮ��������______________����(�ѧʽ)��
����Һ��ij�������ʵ���Ũ�ȵ���1.0��10-5 mol��L-1ʱ������Ϊ�ѳ�����ȫ������һ��Ũ�ȵ�AlCl3��FeCl3�Ļ����Һ����μ��백ˮ����Fe3+�պ���ȫ����ʱ���ⶨc(Al3+)=0.2mol��L-1����ʱ���ó�����___________(������������������������)Al(OH)3��
���𰸡�+41.19kJ��mol-1 �ϵ��¶� BD ABD ��>��>��>��>�� ![]() ��10-2 D Al(OH)3 ������
��10-2 D Al(OH)3 ������
��������
��1�����ݸ�˹���ɶ��Ȼ�ѧ����ʽ������Ӽ���
��2���÷�Ӧ���ص����ؼ����ʼ������Ե����Է���
��3���ж�ƽ��Ľ�����Ҫ�����淴Ӧ�����Ƿ���ȣ����߱������䣻
��4�������ݺ����꣬CO2ƽ��ת���������¶ȵ����߶����ͣ���Ч�����¶ȵ�������������С��
��5���ٸ���ksp��ֵһһ�����������Һ��������Ũ�ȣ��ٽ��бȽϣ�
������Ksp��AgBr����Ksp��AgCl���ı���ʽ�����Ƶ���
�����������ⶨˮ�����Ȼ��ﺬ�����ɸ����ܽ��Դ�Сѡ��ָʾ����
��6���ٸ����ܶȻ��������ʼ����ʱ��Ҫ��c(OH-)�����ж�˭�ȳ�����
�������Fe3+��ȫ����ʱ����Һ�е�c(OH-)��������Ũ�����ж�Al3+�Ƿ������
(1) ��Ӧ����CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ��H1=-49.58kJ��mol-1
CH3OH(g)+H2O(g) ��H1=-49.58kJ��mol-1
��Ӧ����CO2(g)+H2(g)![]() CO(g)+H2O(g) ��H2
CO(g)+H2O(g) ��H2
��Ӧ����CO(g)+2H2(g)![]() CH3OH(g) ��H3=-90.77kJ��mol-1
CH3OH(g) ��H3=-90.77kJ��mol-1
�Ա�������Ӧʽ�����ݸ�˹���ɿ�֪����ӦII=��ӦI-��ӦIII���ɴ˿ɵ÷�ӦII����H2=+41.19 kJ��mol-1��
(2)�÷�Ӧ����S<0����H<0������Ӧ���Է�ʱ��������G=��H-T��S<0����ʱҪ���¶Ƚϵͣ�
(3) A�����������������������䣬����������ܶ�ʼ�ղ��䣬�ܶȲ���Ͳ��������жϸ÷�Ӧ�Ƿ�ﵽƽ�⣬A�����
B���÷�Ӧ��һ�������������������С�ķ�Ӧ����Ӧ���ҽ��У���������ƽ����Է���������������ƽ����Է������������˵���÷�Ӧ�Ѵﵽƽ��״̬��B����ȷ��
C��ƽ��ʱ�Ǹ����ʵ�Ũ�Ȼ������䣬����Ũ����ȣ�Ҳ���dzɱ�����C�����
D��ƽ�����Ҫ�������Ǹ����Ũ�ȡ������Ȳ��䡣�״��İٷֺ������ٱ仯����˵���÷�Ӧ�ﵽƽ��״̬��D����ȷ��
���Դ�ѡ��BD����
(4) A��������Ӱ��ƽ���ƶ������������������䣬����ʹ�ô�������250��ʱCO2ƽ��ת����Ҳһ��λ�������ϵ�M�㣬��������M1����A�����
B���¶ȵ���250��ʱ�����¶����߶�����̼ת���ʽ��ͣ���״��IJ��ʼ�С��B�����
C���÷�Ӧ������ȣ�����ʹƽ�����ƣ�ƽ�ⳣ������С����M��ʱƽ�ⳣ����N��ƽ�ⳣ����C����ȷ��
D���¶�Խ�ͷ�ӦԽ�����������������Ҵ����л����¶ȣ�250�����ң���D�����
���Դ�ѡ��ABD�
(5)��AgCl������Һ��c��Ag+��=![]() ��10-5mol/L��AgBr������Һ��c��Ag+��=
��10-5mol/L��AgBr������Һ��c��Ag+��=![]() ��10-7 mol/L��AgI������Һ��c��Ag+��=
��10-7 mol/L��AgI������Һ��c��Ag+��=![]() ��10-9mol/L��Ag2S������Һ��c��Ag+��=2��
��10-9mol/L��Ag2S������Һ��c��Ag+��=2��![]() ��10-17 mol/L��Ag2CrO4������Һ��c��Ag+��=2��
��10-17 mol/L��Ag2CrO4������Һ��c��Ag+��=2��![]() ��10-4 mol/L��Ag+���ʵ���Ũ���ɴ�С��˳����Ag2CrO4>AgCl>AgBr>AgI>Ag2S��������>��>��>��>�ܣ�
��10-4 mol/L��Ag+���ʵ���Ũ���ɴ�С��˳����Ag2CrO4>AgCl>AgBr>AgI>Ag2S��������>��>��>��>�ܣ�
��![]() =
=![]() =
=![]() =
=![]() =3��10-3��
=3��10-3��
(6)�ٸ���Al(OH)3��Cu(OH)2���ܶȻ���������25��ʱ����Ũ�Ⱦ�Ϊ0.1mol/L��AlCl3��CuCl2�Ļ����Һ����μ��백ˮ����ʼ����Al(OH)3��Cu(OH)2����ʱ��Ҫc��OH-����Ũ�ȷֱ�Ϊ��![]() ��
��![]() ���Ӷ��ߵ��������Ϳ��Կ�����ǰ��С�ں��ߣ�����Al(OH)3�ȳ���������
���Ӷ��ߵ��������Ϳ��Կ�����ǰ��С�ں��ߣ�����Al(OH)3�ȳ���������
��Fe3+��ȫ����ʱ��c(OH-)3=![]() ������c(Al3+)��c(OH-)3=0.2��4.0��10-33=8��10-34<Ksp[Al(OH)3]������û������Al(OH)3������
������c(Al3+)��c(OH-)3=0.2��4.0��10-33=8��10-34<Ksp[Al(OH)3]������û������Al(OH)3������

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ��ij�¶��£���ӦH2(g)+CO2(g)![]() H2O(g)+CO(g)��ƽ�ⳣ��K=
H2O(g)+CO(g)��ƽ�ⳣ��K=![]() �����¶��£��ڼס��ҡ������������ܱ������У�Ͷ��H2(g)��CO2(g)������ʼŨ�������ʾ��
�����¶��£��ڼס��ҡ������������ܱ������У�Ͷ��H2(g)��CO2(g)������ʼŨ�������ʾ��
�� | �� | �� | |
c(H2)/(mol��L-1) | 0.010 | 0.020 | 0.020 |
c(CO2)/(mol��L-1) | 0.010 | 0.010 | 0.020 |
�����жϲ���ȷ����( )
A. ��Ӧ��ʼʱ���������л�ѧ��Ӧ������������л�ѧ��Ӧ������С
B. ƽ��ʱ����������CO2��ת���ʴ���60%
C. ƽ��ʱ���������кͱ�������H2��ת���ʾ���60%
D. ƽ��ʱ����������c(CO2)�Ǽ������е�2������ 0.012 mol��L-1
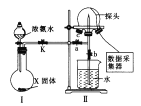
����Ŀ����ͼ���е��ʵ��(A��B��C��D��Ϊ���Ե缫)���ɹ�ѡ��ĵ������Һ�����±��С�Ҫ������������ǣ�
�ٹ���һ��ʱ��������Һ��pH������������Һ��pH�½���
��B��C�����Ϸŵ�����ӵ����ʵ�����ȡ�
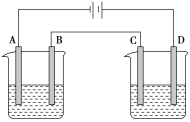
�� ������������ ��
��� | �� | �� | �� | �� |
���ձ� | NaOH��Һ | NaCl��Һ | H2SO4��Һ | AgNO3��Һ |
���ձ� | CuSO4��Һ | AgNO3��Һ | AgNO3��Һ | CuCl2��Һ |
(1)Ӧѡ��ĵ������Һ��________�顣
(2)�缫��Ӧʽ��B��______________________��D��___________________________��
(3)��B��������3.55g������ʱ��C��������______�����������ƣ�������Ϊ______g��
����Ŀ��I��ijѧ����0.100molL-1��KOH����Һ�ζ�δ֪Ũ�ȵ����ᣬ������ɷֽ�Ϊ���¼�����
A����ȡ20mL����������Һע��ྻ����ƿ�У�������2��3�η�̪��
B���ñ���Һ��ϴ�ζ���2��3�Σ�
C����ʢ�б���Һ�ļ�ʽ�ζ��̶ܹ��ã����ڵζ���ʹ���촦������Һ��
D��ȡ��KOH��Һע���ʽ�ζ������̶ȡ�0������2��3cm ����
E������Һ������0����0�����¿̶ȣ����¶�����
F������ƿ���ڵζ��ܵ����棬�ñ�KOH��Һ�ζ����յ㲢���µζ���Һ��Ŀ̶ȡ�
ʵ���� | KOH��Һ��Ũ�ȣ�mol/L�� | �ζ����ʱ��KOH��Һ����������mL�� | ����������Һ�������mL�� |
1 | 0.10 | 22.62 | 20.00 |
2 | 0.10 | 22.72 | 20.00 |
3 | 0.10 | 22.80 | 20.00 |
�ʹ�ʵ�������գ�
��1����ȷ���������˳���ǣ��������ĸ��д��_____��
��2�������������ݣ��ɼ�����������Ũ��ԼΪ_____��������λ��Ч���֣�
II������������һ�ֳ���ʳƷ���Ӽ���Ϊ����ijʳƷ���������κ���(ͨ����1kg��Ʒ�к�SO2��������)��ij�о�С���á���������ԭ�ζ��������вⶨ��ʵ���������£�
��1�����ҺӦѡ��____(���ʽ����ʽ��)�ζ���ʢװ����ע��Һ֮ǰ����Եζ��ܽ��в�©��ϴ�ӡ�____��
��2����ƿ�ڵ�ָʾ��Ϊ_____���жϴﵽ�ζ��յ��������________��
��3�����в�����ʹ�ⶨ���ƫ�����_______
A����ʼ����ʱƽ�ӣ��յ����ʱ����
B��δ�ñ�Һ��ϴ�ζ���
C�����������ϡ�������ϡ����
��4����ȡ��Ʒw g�����ҷ����������0.01000mol��L-1 I2��ҺVmL����1kg��Ʒ�к�SO2��������____g(�ú�w��V�Ĵ��� )��
����Ŀ��ʳ�ð״���Ч�ɷ�Ϊ���ᣨCH3COOH������ʹ������к͵ζ������вⶨ�����ñ�NaOH��Һ�ⶨ���ۡ��Ϻ��״ס�����������g/100mL��������дʵ�鱨���еĿհ״���
��ʵ��Ŀ�ģ��ⶨ���ۡ��Ϻ��״ס���������
��ʵ����Ʒ������ˮ���Ϻ��״ף�0.1000mol/LNaOH����Һ����̪��100mL����ƿ��___________�����������ζ��ܣ���ƿ���ձ�������̨��������
��ʵ�鲽�裩
��1�����Ʋ���ȡ����ʳ����Һ��
����___________�����������ƣ���ȡ10.00mLʳ�ð״ף�ע���ձ�����ˮϡ�ͺ�ת�Ƶ�100mL����ƿ�ж��ݣ�ҡ�ȼ��á�
��ȡ����״���Һ20.00 mL����ƿ�У����μ�2�η�̪��ָʾ����
��2��ʢװ��NaOH��Һ���ζ��ܾ���ϴ�Ӻ�װ��NaOH����Һ��ʹҺ��λ��________________________________����¼�ζ��ܵij���������Һ��λ����ͼ��ʾ�����ʱ�Ķ���Ϊ____________mL��
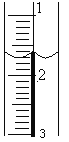
��3���ζ�����_____________________________________________ʱ��Ϊ�ζ��յ㡣�ζ������յ���¼NaOH��Һ���յ���������ظ��ζ�3�Ρ�
�����ݼ�¼�봦����
�ζ����� ʵ������ | 1 | 2 | 3 | 4 |
����ʳ�����/mL | 20.00 | 20.00 | 20.00 | 20.00 |
�ζ��ܳ�����/mL | 0.00 | 0.20 | 0.10 | 0.15 |
�ζ���ĩ����/mL | 15.95 | 16.20 | 15.15 | 16.20 |
��4����ͬѧ�ڴ�������ʱ����ã�����NaOH��Һ��ƽ�����(V)��![]() ��15.76 mL��ָ������IJ�����֮����____________________________________________��
��15.76 mL��ָ������IJ�����֮����____________________________________________��
��5������ȷ���ݴ������㣬���Ϻ��״ס�����������___________g/100mL��
��˼�������ۣ�
��6���鿴ƿʾ�������5g/100mL���Դ���ƣ�����˴β���������������Ϊ________��
��7�����в����п�����ɸò���������____________������ţ���
a. δ�ñ�NaOH��Һ��ϴ�ζ��� b. ��ƿ�ڵζ�ʱ����ҡ����������Һ�彦��
c. �ζ�ǰδ���ߵζ��ܼ����е����� d. ��ƿ�м������״���Һ���ټ�����ˮ