题目内容
【题目】I.某学生用0.100molL-1的KOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
A.移取20mL待测盐酸溶液注入洁净的锥形瓶中,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管使尖嘴处充满溶液;
D.取标准KOH溶液注入碱式滴定管至刻度“0”以上2~3cm 处;
E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度。
实验编号 | KOH溶液的浓度(mol/L) | 滴定完成时,KOH溶液滴入的体积(mL) | 待测盐酸溶液的体积(mL) |
1 | 0.10 | 22.62 | 20.00 |
2 | 0.10 | 22.72 | 20.00 |
3 | 0.10 | 22.80 | 20.00 |
就此实验完成填空:
(1)正确操作步骤的顺序是(用序号字母填写)_____。
(2)根据上述数据,可计算出该盐酸的浓度约为_____(保留两位有效数字)
II.亚硫酸盐是一种常见食品添加剂。为检验某食品中亚硫酸盐含量(通常以1kg样品中含SO2的质量计),某研究小组用“碘氧化还原滴定法”进行测定,实验流程如下:
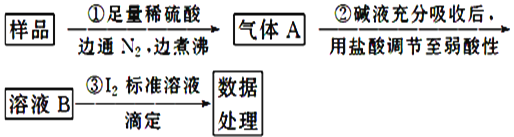
(1)碘标准液应选用____(填“酸式”或“碱式”)滴定管盛装,加注标准液之前必须对滴定管进行查漏、洗涤、____。
(2)锥形瓶内的指示剂为_____,判断达到滴定终点的依据是________。
(3)下列操作会使测定结果偏大的有_______
A.起始读数时平视,终点读数时俯视
B.未用标准液润洗滴定管
C.步骤①中用稀盐酸代替稀硫酸
(4)若取样品w g,按乙方案测得消耗0.01000mol·L-1 I2溶液VmL,则1kg样品中含SO2的质量是____g(用含w、V的代数 )。
【答案】B、D、C、E、A、F 0.11 mol·L-1 酸式 润洗 淀粉溶液 滴入最后一滴时,溶液由无色变为浅蓝色,且半分钟不褪色 B ![]() g
g
【解析】
I.(1)在使用滴定管装液前要先检漏,再洗涤,再润洗;
(2)判断数据是否有效,再取标准液体积平均值进行计算;
II.(1)具有氧化性的溶液会腐蚀橡胶管;滴定管装液前要使用待装液润洗;
(2)碘液一过量,淀粉就变蓝;
(3)利用c(待测)=![]() 进行分析判断;
进行分析判断;
(4)写出反应方程式,根据硫原子守恒进行计算;
(1)滴定管在使用前要检漏,然后用蒸馏水洗涤干净、用待装液润洗2~3次,最后再装液。调整好液面至0刻度或以下后,再将待测液盐酸放入锥形瓶20.00mL,并加入指示剂。用KOH标准溶液进行滴定,记下终点时液面刻度,所以正确的操作步骤为:B、D、C、E、A、F;
(2)c(HCl)=![]() =
=![]() ≈0.11 mol·L-1;
≈0.11 mol·L-1;
II.(1)因碘溶液具有氧化性并会溶于橡胶中,从而腐蚀橡胶管,所以碘溶液用酸式滴定管盛装;滴定管在检漏、用蒸馏水洗涤后,还要用少量待装液润洗2~3次,以免待装液被稀释;
(2)淀粉遇碘单质变蓝色,所以可以选用淀粉溶液作为指示剂,这样,只要碘溶液一过量,溶液立即由无色变为蓝色;判断终点到达的规范化表述为:当最后一滴碘溶液滴入锥形瓶时,锥形瓶内溶液突然由无色变为蓝色,且保持半分钟不褪色;
(3)A.起始读数平视是正确的,终点读数俯视,会使终点时体积读小,则计算时耗用标准液体积偏小,最终测定结果偏小,A项不选;
B.未用标准液润洗滴定管,标准液会被稀释,消耗的标准液体积虚高,所以使计算的结果偏大,B项正确;
C.因为是利用I2氧化+4价的硫,盐酸和硫酸都可以将食品样品中的亚硫酸盐转化为二氧化硫,所以盐酸代替硫酸,对实验结果无影响,C项不选;
所以答案选择B项;
(4)涉及的反应为:H2O+SO32-+I2=SO42-+2I-+2H+,可以看出:n(SO2)=n(SO32-)=n(I2)=0.01000mol·L-1×V×10-3L=V×10-5mol,其质量为64g·mol-1×V×10-5mol=0.00064Vg,所以1kg样品中含SO2的质量为:![]() 。
。

 全能测控期末小状元系列答案
全能测控期末小状元系列答案 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案【题目】相同温度下,容积均恒为2L的甲、乙、丙3个密闭容器中发生反应:2SO2(g)+O2(g)![]() 2SO3(g); △H=-197kJ·mol-l。 实验测得起始、平衡时的有关数据如下表:
2SO3(g); △H=-197kJ·mol-l。 实验测得起始、平衡时的有关数据如下表:
容器 | 起始各物质的物质的量/mol | 达到平衡时体系能量的变化 | |||
SO2 | O2 | SO3 | Ar | ||
甲 | 2 | 1 | 0 | 0 | 放出热量:Q1 |
乙 | 1.8 | 0.9 | 0.2 | 0 | 放出热量:Q2=78.8kJ |
丙 | 1.8 | 0.9 | 0.2 | 0.1 | 放出热量:Q3 |
下列叙述正确的是( )
A.Q1>Q3>Q2 =78.8kJ
B.三个容器中反应的平衡常数均为K=2
C.甲中反应达到平衡时,若升高温度,则SO2的转化率将大于50%
D.若乙容器中的反应经tmin达到平衡,则0~tmin内,v(O2)=1/5t mol/(L·min)
【题目】甲醇是一种可再生能源,由二氧化碳制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.58kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.58kJ·mol-1
反应Ⅱ:CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g)![]() CH3OH(g) △H3=-90.77kJ·mol-1
CH3OH(g) △H3=-90.77kJ·mol-1
回答下列问题:
(1)反应Ⅱ的△H2=_________________。
(2)反应Ⅲ能够自发进行的条件是_______________ (填“较低温度” “较高温度”或“任何温度” )。
(3)恒温,恒容密闭容器中,对于反应Ⅰ,下列说法中能说明该反应达到化学平衡状态的是______。
A.混合气体的密度不再变化
B.混合气体的平均相对分子质量不再变化
C.CO2、H2、CH3OH、H2O的物质的量之比为1:3:1:1
D.甲醇的百分含量不再变化
(4)对于反应Ⅰ,不同温度对CO2的转化率及催化剂的效率影响如图所示,下列有关说法不正确的是__________。
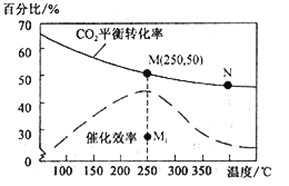
A.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于M1
B.温度低于250 ℃时,随温度升高甲醇的产率增大
C.M 点时平衡常数比N点时平衡常数大
D.实际反应应尽可能在较低的温度下进行,以提高CO2的转化率
(5)已知下列物质在20℃下的Ksp如下,试回答下列问题:
编号 | ① | ② | ③ | ④ | ⑤ |
化学式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
颜色 | 白色 | 浅黄色 | 黄色 | 黑色 | 红色 |
Ksp | 1.8×10-10 | 5.4×10-13 | 8.3×10-17 | 6.3×10-50 | 2.0×10-12 |
①20℃时,上述五种银盐饱和溶液中,Ag+物质的量浓度由大到小的顺序是(填编号)____________。
②向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时c(Br-)/c(Cl-)=________________。
③ 测定水体中氯化物的含量,常用标准硝酸银法进行滴定,滴定时,应加入的指示剂是____。
A.KBr B.KI C.K2S D.K2CrO4
(6)已知25℃时Ksp[Mg(OH)2]=5.6×10-12,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Al(OH)3]=1.1×10-33。
①在25℃下,向浓度均为0.1 mol·L-1的AlCl3和CuCl2混合溶液中逐滴加入氨水,先生成______________沉淀(填化学式)。
②溶液中某离子物质的量浓度低于1.0×10-5 mol·L-1时,可认为已沉淀完全。现向一定浓度的AlCl3和FeCl3的混合溶液中逐滴加入氨水,当Fe3+刚好完全沉淀时,测定c(Al3+)=0.2mol·L-1。此时所得沉淀中___________(填“还含有”或“不含有”)Al(OH)3。