题目内容
【题目】一定温度下,在1 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是
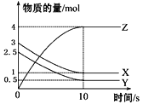
A.反应的化学方程式为2X(g)+Y(g)![]() 2Z(g)
2Z(g)
B.反应开始到10 s,用Z表示的反应速率为0.3 mol·L-1·s-1
C.10 s后,该反应停止进行
D.反应开始到10 s时,反应速率:υ(X)=υ(Y)=0.2 mol·L-1·s-1
【答案】D
【解析】
由图片可知X、Y为反应物,Z为生成物,根据变化量之比等于计量数之比确定方程式,再利用三段法进行计算。
由图片可知X、Y为反应物,Z为生成物,10s内X的变化量为2mol,Y的变化量为2mol,Z的变化量为4mol,变化量之比等于计量数之比,则方程式为X(g)+Y(g)![]() 2Z(g),v(Z)=
2Z(g),v(Z)=![]() =
=![]() =0.4 mol·L-1·s-1,反应进行10s后达到平衡状态,并没有停止进行;又速率之比等于化学计量数之比,所以υ(X)=υ(Y)=0.2 mol·L-1·s-1;
=0.4 mol·L-1·s-1,反应进行10s后达到平衡状态,并没有停止进行;又速率之比等于化学计量数之比,所以υ(X)=υ(Y)=0.2 mol·L-1·s-1;
答案选D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
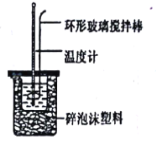
小学生10分钟应用题系列答案【题目】实验室用50mL0.50mol/L盐酸、50mL0.55mol/LNaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:
实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | NaOH溶液 | ||
1 | 20.3 | 20.3 | 23.7 |
2 | 20.3 | 20.5 | 23.8 |
3 | 21.5 | 21.6 | 26.9 |
完成下列问题:
(1)根据上表中所测数据,该实验中和热△H=___。(不必计算和化简,代入数据即可)[盐酸和NaOH溶液的密度按1g/cm3计算,反应后混合溶液的比热容(c)按4.18J/(g·℃)计算]。
(2)在该实验过程中,该同学需要测定的实验数据有___(填序号)。
A.盐酸的浓度 B.盐酸的温度
C.氢氧化钠溶液的浓度 D.氢氧化钠溶液的温度
E.水的比热容 F.反应后混合溶液的终止温度