题目内容
【题目】配制VmL 2.0mol·L-1的氢氧化钠溶液,需要氢氧化钠固体质量______ g。 下列操作,会使所配的溶液浓度如何变化。
(1)称取氢氧化钠固体时将固体放在天平托盘的纸片上:______ ;
(2)称量时左码右物,且使用了游码:_______;
(3)容量瓶用蒸馏水洗净,没有烘干:________;
(4)没有等到溶液冷却到室温就将溶液注入容量瓶中:______;
(5)转移溶液时有溶液撒出:_____,
(6)没有用蒸馏水洗烧杯和玻璃棒:____,
(7)定容时仰视液面:_____,
(8)定容时俯视液面:____。
【答案】0.08V 降低 降低 不变 升高 降低 降低 升高 降低
【解析】
首先根据![]() 算出需要的
算出需要的![]() 的物质的量,再代入摩尔质量算出质量即可;在误差分析时按照
的物质的量,再代入摩尔质量算出质量即可;在误差分析时按照![]() 来分析,看看这些操作究竟会影响溶质的物质的量n还是溶液的体积V。
来分析,看看这些操作究竟会影响溶质的物质的量n还是溶液的体积V。
根据![]() 算出
算出![]() 的物质的量,再根据
的物质的量,再根据![]() 算出
算出![]() 的质量,接下来进行误差
的质量,接下来进行误差
(1)用纸片称量会造成部分![]() 残留在纸片上,n小了浓度降低;
残留在纸片上,n小了浓度降低;
(2)左码右物会导致实际称取的![]() 比需要的少,n小了浓度降低;
比需要的少,n小了浓度降低;
(3)容量瓶本身就要加蒸馏水定容,一开始存在少量蒸馏水无影响;
(4)根据热胀冷缩原理,热溶液的体积膨胀,因此实际上加的水会减少,V小了浓度升高;
(5)若转移时有溶液洒出,相当于部分![]() 溶质被洒出,n小了浓度降低;
溶质被洒出,n小了浓度降低;
(6)若不洗烧杯和玻璃棒,势必会有少量![]() 溶质未转移到容量瓶中,n小了浓度降低;
溶质未转移到容量瓶中,n小了浓度降低;
(7)根据仰小俯大原则,仰视液面会导致定容时实际加入的水低于刻度线,V小了浓度升高;
(8)根据仰小俯大原则,俯视液面会导致定容时实际加入的水高于刻度线,V大了浓度降低。

【题目】为探究Na与CO2反应的产物,某化学兴趣小组按如图所示装置进行实验。
己知:CO+2Ag(NH3)2OH=2Ag↓+ (NH4)2CO3+2NH3
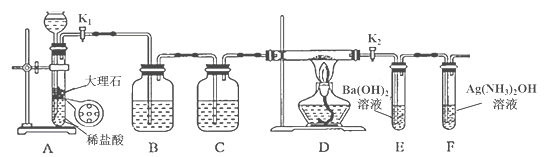
回答下列问题:
(1)B中的溶液为______________。
(2)先称量硬质玻璃管的质量为ml g,将样品装入硬质玻璃管中,称得样品和硬质玻璃管的总质量是m2 g。再进行下列实验操作,其正确顺序是____________(填标号);重复上述操作步骤,直至硬质玻璃管恒重,称得质量为m3 g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.称量硬质玻璃管
d.打开K1和K2,通入CO2至E中出现浑浊 e.关闭K1和K2 f.冷却到室温
(3)加热硬质玻璃管一段时间,观察到以下现象:
①钠块表面变暗,熔融成金属小球;
②继续加热,钠迅速燃烧,产生黄色火焰。反应完全后,管中有大量黑色物质;
③F中试管内壁有银白物质产生。
产生上述②现象的原因是____________________________________________________;
(4)探究固体产物中钠元素的存在形式
假设一:只有Na2CO3; 假设二:只有Na2O; 假设三:Na2O和Na2CO3均有;
完成下列实验设计,验证上述假设:
步骤 | 操作和现象 | 结论 |
1 | 将硬质玻璃管中的固体产物溶于水后过滤; | 假设一成立 |
2 | 往步骤1所得滤液中_________________________________; 现象:____________________________________。 |
(5)根据上述实验现象及下表实验数据,写出Na与CO2反应的总化学方程式_____________。
m1 | m2 | m3 |
66.7g | 69.0g | 72.1g |