题目内容
(2013?肇庆一模)铜是一种重要的金属元素,位于元素周期表第ⅠB族,+1价的铜与氯离子结合的生成的CuCl是一种难溶物质,但它可与过量的Cl-形成可溶于水的络离子[CuCl2]-.含铜最丰富的天然资源是黄铜矿(CuFeS2).
(1)目前有一种湿法冶炼技术,以黄铜矿为主要原料来生产铜、铁红颜料和可用于橡胶硫化的硫单质,原料的综合利用率较高.其主要流程如下:
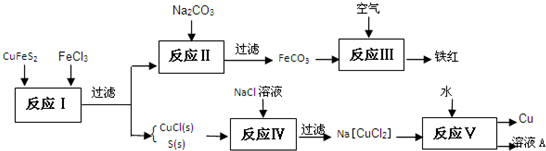
①请完成反应Ⅰ中FeCl3与CuFeS2反应的化学方程式:
CuFeS2+
②写出反应Ⅳ中发生反应的离子方程式:
③反应Ⅲ是FeCO3在空气中煅烧,其化学方程式是
④已知Cu+ 在反应V中发生自身氧化还原反应,歧化为Cu2+和Cu.则反应Ⅴ所得溶液A中含有的溶质有
(2)传统工艺从黄铜矿冶炼粗铜的技术,是将精选后的富铜矿砂与空气在高温下煅烧,使其转变为铜.与上面湿法冶炼技术方法比较,新方法的优点是
(1)目前有一种湿法冶炼技术,以黄铜矿为主要原料来生产铜、铁红颜料和可用于橡胶硫化的硫单质,原料的综合利用率较高.其主要流程如下:

①请完成反应Ⅰ中FeCl3与CuFeS2反应的化学方程式:
CuFeS2+
3
3
FeCl3=CuCl
CuCl
+4FeCl2
FeCl2
+2S.②写出反应Ⅳ中发生反应的离子方程式:
Cl-+CuCl=[CuCl2]-
Cl-+CuCl=[CuCl2]-
.③反应Ⅲ是FeCO3在空气中煅烧,其化学方程式是
4FeCO3+O2
+2Fe2O3
| ||
4FeCO3+O2
+2Fe2O3
.
| ||
④已知Cu+ 在反应V中发生自身氧化还原反应,歧化为Cu2+和Cu.则反应Ⅴ所得溶液A中含有的溶质有
CuCl2、NaCl
CuCl2、NaCl
.(2)传统工艺从黄铜矿冶炼粗铜的技术,是将精选后的富铜矿砂与空气在高温下煅烧,使其转变为铜.与上面湿法冶炼技术方法比较,新方法的优点是
不会产生SO2污染大气
不会产生SO2污染大气
、不用煅烧黄铜矿从而节约热能
不用煅烧黄铜矿从而节约热能
.分析:(1)①CuFeS2和FeCl3之间发生的是氧化还原反应;
②结合CuCl和NaCl反应生成Na[CuCl2]分析书写离子方程式;
③FeCO3在空气中煅烧会和氧气发生氧化还原反应;
④Cu+ 在反应V中发生自身氧化还原反应,歧化为Cu2+和Cu,同时溶液中还含有可溶性的钠盐;
(2)从环保节能方面分析.
②结合CuCl和NaCl反应生成Na[CuCl2]分析书写离子方程式;
③FeCO3在空气中煅烧会和氧气发生氧化还原反应;
④Cu+ 在反应V中发生自身氧化还原反应,歧化为Cu2+和Cu,同时溶液中还含有可溶性的钠盐;
(2)从环保节能方面分析.
解答:解:(1)①该反应中氯化铁中铁离子得电子发生还原反应,CuFeS2中铁、铜元素都显+2价,S元素显-2价,CuFeS2中硫元素失电子发生氧化反应生成硫单质,根据流程图知,铜离子被还原生成亚铁离子,铁离子被还原生成亚铁离子,氧化还原反应中得失电子相等知该反应方程式为CuFeS2+3FeCl3=CuCl↓+4FeCl2+2S↓,
故答案为:3;CuCl;FeCl2;
②反应Ⅳ中氯化钠和难溶性的氯化亚铜反应生成配合物,离子反应方程式为Cl-+CuCl=[CuCl2]-,
故答案为:Cl-+CuCl=[CuCl2]-;
③氧化铁在高温下煅烧生成三氧化二铁和二氧化碳,反应方程式为4FeCO3+O2
+2Fe2O3,
故答案为:4FeCO3+O2
+2Fe2O3;
④反应Ⅴ为Na[CuCl2]和H2O的反应,根据题给信息知生成物是Cu、NaCl和CuCl2,所得的溶液中的溶质是CuCl2、NaCl,故答案为:CuCl2、NaCl;
(2)该反应中不会产生二氧化硫,二氧化硫是形成酸雨的主要成分且有毒,煅烧黄铜矿还需要大量热能,采用此法时不产生二氧化硫,且能节约热能,故答案为:不会产生SO2污染大气,不用煅烧黄铜矿从而节约热能.
故答案为:3;CuCl;FeCl2;
②反应Ⅳ中氯化钠和难溶性的氯化亚铜反应生成配合物,离子反应方程式为Cl-+CuCl=[CuCl2]-,
故答案为:Cl-+CuCl=[CuCl2]-;
③氧化铁在高温下煅烧生成三氧化二铁和二氧化碳,反应方程式为4FeCO3+O2
| ||
故答案为:4FeCO3+O2
| ||
④反应Ⅴ为Na[CuCl2]和H2O的反应,根据题给信息知生成物是Cu、NaCl和CuCl2,所得的溶液中的溶质是CuCl2、NaCl,故答案为:CuCl2、NaCl;
(2)该反应中不会产生二氧化硫,二氧化硫是形成酸雨的主要成分且有毒,煅烧黄铜矿还需要大量热能,采用此法时不产生二氧化硫,且能节约热能,故答案为:不会产生SO2污染大气,不用煅烧黄铜矿从而节约热能.
点评:本题考查了铜的冶炼,根据物质的性质来分析解答,易错点为(1)③,注意煅烧碳酸亚铁时生成氧化铁而不是氧化亚铁,为易错点.

练习册系列答案
相关题目
(2013?肇庆一模)下列实验操作、现象与结论对应关系正确的是( )
|
 (2013?肇庆一模)消除汽车尾气是减少城市空气污染的热点研究课题.
(2013?肇庆一模)消除汽车尾气是减少城市空气污染的热点研究课题.