题目内容
【题目】过氧化钙是白色结晶,用做杀菌剂、防腐剂、解酸剂、油类漂白剂及封闭胶泥的快干剂。在食品、牙粉和化妆品等制造中用作添加剂,也可用作氧化物阴极材料。农业上用作种子及谷物的无毒性消毒剂。可作为水产养殖中广泛使用的供氧剂。
(1)过氧化钙制备方法很多
①制备方法一:氢氧化钙与60%的过氧化氢在催化剂存在下反应而得,其化学方程式为_____________。
②制备方法二:利用反应CaCl2+H2O2+2NH3·H2O+6H2O= CaO2·8H2O+2NH4Cl。在碱性环境中制取CaO2。NH3·H2O在Ca2+和H2O2的反应中所起的作用是_______________________; 该反应需要在冰水浴条件下完成,原因是________________________。
③制备方法三:利用反应Ca(s)+O2![]() CaO(s),在纯氧条件下制取CaO2,实验室模拟装置示意图如图所示:
CaO(s),在纯氧条件下制取CaO2,实验室模拟装置示意图如图所示:

请回答下列问题:
装置A中发生反应的化学方程式为_______________;装置D中盛有的液体是浓硫酸,其作用一是观察氧气的流速,判断氧气通入是否过快及氧气与钙反应进行的程度;二是_________________。
(2)水中溶氧量(DO)是衡量水体自净能力的一个指标,通常用每升水中溶解氧分子的质量表示,单位mg·L-1。测定原理为碱性条件下,O2将Mn2+氧化为MnO(OH)2:2Mn2++O2+4OH-=2MnO(OH)2↓;酸性条件下,MnO(OH)2将I-氧化为I2:MnO(OH)2+2I-+4H+=Mn2++I2+3H2O;用Na2S2O3标准溶液滴定生成的I2:2S2O32-+I2=S4O62-+2I-。取加过一定量 CaO2·8H2O的池塘水样100.0mL,按上述方法测定水中的溶氧量,消耗0.01000mol·L-1Na2S2O3标准溶液13.50mL。滴定过程中使用的指示剂是 ___________;该水样中的溶解氧量(DO)为_______________。
【答案】 ①Ca(OH)2+H2O2=CaO2+2H2O 中和过氧化氢和Ca2+反应产生的氢离子,促进反应的进行(或中和反应生成的HCl,使反应CaCl2+H2O2= CaO2+2HCl) (向右进行) 防止H2O2发生分解 2H2O2![]() 2H2O+O2↑ (或2Na2O2+2H2O=4NaOH+O2↑) 防止空气进入C装置影响产品纯度 淀粉溶液 10.80mg·L-1
2H2O+O2↑ (或2Na2O2+2H2O=4NaOH+O2↑) 防止空气进入C装置影响产品纯度 淀粉溶液 10.80mg·L-1
【解析】(1)①氢氧化钙与60%的过氧化氢在催化剂存在下反应生成过氧化钙和水,类似复分解反应,化学方程式为Ca(OH)2+H2O2=CaO2+2H2O;②中和过氧化氢和Ca2+反应产生的氢离子,促进反应的进行(或中和反应生成的HCl,使反应CaCl2+H2O2= CaO2+2HCl) (向右进行);双氧水受热易分解,在冰水浴条件下可防止H2O2发生分解;③装置A是制备氧气的发生装置,应是双氧水分解反应,化学方程式为2H2O2![]() 2H2O+O2↑ (或2Na2O2+2H2O=4NaOH+O2↑) ;因过氧化钙易与水反应,整个制备应干燥纯氧条件下进行,D装置可以防止空气进入C装置影响产品纯度。
2H2O+O2↑ (或2Na2O2+2H2O=4NaOH+O2↑) ;因过氧化钙易与水反应,整个制备应干燥纯氧条件下进行,D装置可以防止空气进入C装置影响产品纯度。
用Na2S2O3标准溶液滴定生成的I2,可以用淀粉溶液作为滴定终点判断的现象依据;由方程式找出关系式(电子守恒)为:O2——2MnO(OH)2——2 I2——4 S2O32—,代入计算:
所以该水样中的溶解氧为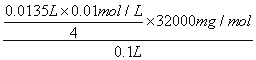 =10.80mg/L。
=10.80mg/L。


