题目内容
【题目】常温下,向20.00mL0.1000mol/L的氨水中逐滴加入0.100mol/L的盐酸,pH随盐酸体积的变化如图所示(不考虑NH3的逸出)。下列说法不正确的
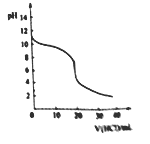
A. 反应过程中: c(NH4+)+c(H+)=c(OH-)+c(Cl-)
B. V(HCl)=10.00mL时,c(NH3·H2O)>c(NH4+)>c(Cl-)
C. V(HCl)<20.00mL时,溶液不一定呈碱性
D. v(HCl)=30.00mL时,2c(Cl-)=3c(NH4+)+3c(NH3·H2O)
【答案】B
【解析】A. 反应过程中,电荷守恒:c(NH4+)+c(H+)=c(OH-)+c(Cl-),故A正确;B. V(HCl)=10.00mL时,一半NH3·H2O转化为NH4Cl,由于NH3·H2O的电离程度大于NH4Cl的水解程度,所以c(NH4+)>c(Cl-)> c(NH3·H2O),故B不正确;C. 当V(HCl)=20.00mL时,反应物恰好完全反应生成NH4Cl溶液,NH4Cl水解使溶液呈酸性,所以V(HCl)<20.00mL时,溶液可能呈碱性或中性或酸性,不一定呈碱性,故C正确;D. v(HCl)=30.00mL时,盐酸过量1/2,所以2c(Cl-)=3c(NH4+)+3c(NH3·H2O),故D正确。故选B。

【题目】用酸式滴定管准确移取25.00mL某未知浓度的盐酸于一洁净的锥形瓶中,然后用0.20mol·L-1的氢氧化钠溶液(指示剂为酚酞)滴定,滴定结果如下:
实验编号 | NaOH起始读数 | NaOH终点读数 |
第一次 | 0.10mL | 18.40mL |
第二次 | 3.00mL | 21.10mL |
第三次 | 0.20mL | 20.40mL |
第四次 | 0.00mL | 18.20mL |
(1)滴定管在使用之前需要先_________,再洗涤和润洗
(2)判断滴定终点的现象是____________________________________。
(3)根据以上数据可以计算出盐酸的物质的量浓度为__________mol·L-1(小数点后保留两位有效数字)。
(4)以下操作可能造成测定结果偏高的是_________(填写序号)。
A.滴定前,碱式滴定管尖有气泡,滴定后消失
B.滴定前读数正确,达到滴定终点后,俯视读数
C.滴定到终点读数时发现滴定管尖处悬挂一滴溶液
D.盛装未知液的锥形瓶用蒸馏水洗后,未用待测液润洗
E.未用盐酸溶液润洗量取用酸式滴定管