题目内容
Ⅰ.用MnO2氧化密度为1.19g?cm-3,溶质质量分数为36.5%的HCl溶液.反应的化学方程式为:MnO2+4HCl
MnCl2+Cl2↑+2H2O
(1)该盐酸的物质的量浓度为______mol/L.
(2)用双线桥法表示出该反应的电子转移方向和数目______.
(3)8.7gMnO2能使______molHCl被氧化.
Ⅱ.在一定体积的18mol/L的浓硫酸中加入过量铜片,加热使之反应,若被还原的硫酸为0.9mol.则浓硫酸的实际体积______(填“大于”、“等于”或“小于”)100mL.若使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如KNO3溶液),则该反应的离子方程式为______.
| ||
(1)该盐酸的物质的量浓度为______mol/L.
(2)用双线桥法表示出该反应的电子转移方向和数目______.
(3)8.7gMnO2能使______molHCl被氧化.
Ⅱ.在一定体积的18mol/L的浓硫酸中加入过量铜片,加热使之反应,若被还原的硫酸为0.9mol.则浓硫酸的实际体积______(填“大于”、“等于”或“小于”)100mL.若使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如KNO3溶液),则该反应的离子方程式为______.
I.(1)由c=
可知,浓度为
=11.9mol/L,故答案为:11.9;
(2)MnO2+4HCl
MnCl2+Cl2↑+2H2O中,Mn元素的化合价由+4价降低为+2价,Cl元素的化合价由-1价升高为0,双线桥法表示出该反应的电子转移方向和数目为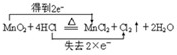 ,故答案为:
,故答案为: ;
;
(3)1mol反应MnO2,转移2mol电子,n(MnO2)=
=0.1mol,则被氧化的HCl为0.1mol×2=0.2mol,故答案为:0.2;
Ⅱ.Cu与浓硫酸反应,随反应的进行,浓硫酸变为稀硫酸,Cu与稀硫酸不反应,所以被还原的硫酸为0.9mol.则浓硫酸的实际体积应大于
,即大于100mL,硝酸盐在酸性条件下具有强氧化性,可氧化Cu,发生的离子反应为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,故答案为:大于;3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
| 1000ρw |
| M |
| 1000×1.19×36.5% |
| 36.5 |
(2)MnO2+4HCl
| ||
 ,故答案为:
,故答案为: ;
;(3)1mol反应MnO2,转移2mol电子,n(MnO2)=
| 8.7g |
| 87g/mol |
Ⅱ.Cu与浓硫酸反应,随反应的进行,浓硫酸变为稀硫酸,Cu与稀硫酸不反应,所以被还原的硫酸为0.9mol.则浓硫酸的实际体积应大于
| 0.9mol×2 |
| 18mol/L |

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目