题目内容
【题目】FeCl3在工业生产中应用广泛,某化学研究性学习小组模拟工业流程制备无水FeCl3。经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。他们设计了制备无水FeCl3的实验方案,装置示意图及操作步骤如下:
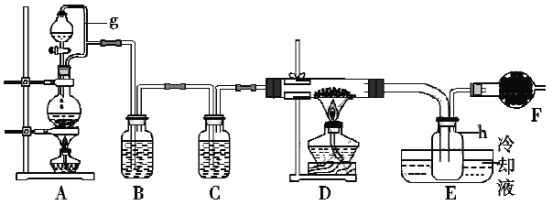
请回答下列问题:
(1)装置A中g管的作用是___;装置B中的试剂是___;E处左方选用较粗玻璃管的原因是___;装置F中盛碱石灰干燥管的作用是___。
(2)检验装置的气密性;点燃A处的酒精灯。写出装置A中发生反应的离子方程式___。
当h中充满黄绿色气体时点燃D处铁屑下方的酒精灯。反应结束,将收集器h密封。
(3)检验收集器h收集到的是FeCl3而木是FeCl2步骤是:①取收集器中的少量样品溶于少量浓盐酸,加水稀释,将溶液分为两份;②一份溶液检验出三价铁离子;③另一份溶液不能检验出二价铁离子。
①中盐酸的作用是___;②中检验出三价铁离子的离子方程式___。③检验无二价铁离子的方法是___。
【答案】平衡压强,使浓盐酸顺利滴下 饱和氯化钠溶液 防止FeCl3凝华堵塞导管 吸收未反应的氯气;防止空气中的水蒸气进入收集装置 ![]() 抑制FeCl3水解 Fe3++3SCN=Fe(SCN)3 滴加K3[Fe(CN)6]溶液,无蓝色沉淀生成
抑制FeCl3水解 Fe3++3SCN=Fe(SCN)3 滴加K3[Fe(CN)6]溶液,无蓝色沉淀生成
【解析】
本实验制备无水FeCl3,A装置制取氯气,B装置除去氯气中混有的氯化氢,C装置进行干燥,可用浓硫酸,D装置中反应生成FeCl3,热易升华成气体进入E装置凝华成FeCl3固体,该实验需要无水环境,F装置用来吸收未反应的氯气同时防止空气进入。
(1)装置A中生成气体,为了使分液漏斗中液体顺利滴下,加导管平衡压强,可使液体顺利滴下;B装置为了出去氯气中混有的氯化氢,用饱和氯化钠溶液;为了防止FeCl3堵塞导管,所以E处左方选用较粗玻璃管;根据分析可知F装置的作用是为了吸收未反应的氯气同时防止空气中的水蒸气进入收集装置,
故答案为:平衡压强,使浓盐酸顺利滴下;饱和氯化钠溶液;防止FeCl3凝华堵塞导管;吸收未反应的氯气;防止空气中的水蒸气进入收集装置;
(2)A装置制取氯气,浓盐酸和二氧化锰共热生成氯气,故离子反应方程式为:![]() ;
;
(3)三价铁会水解,所以需要加浓盐酸抑制其水解;检验三价铁常用KSCN溶液,离子方程式为:Fe3++3SCN=Fe(SCN)3;二价铁可用K3[Fe(CN)6]溶液检验;
故答案为:抑制FeCl3水解;Fe3++3SCN=Fe(SCN)3;滴加K3[Fe(CN)6]溶液,无蓝色沉淀生成;

 导学教程高中新课标系列答案
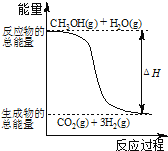
导学教程高中新课标系列答案【题目】CCuS是一种二氧化碳的捕获、利用与封存的技术,这种技术可将CO2资源化, 产生经济效益。CO2经催化加氢可以生成低碳有机物,主要有以下反应:
反应I:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H1=-49.8kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.8kJ·mol-1
反应II:CH3OCH3(g)+H2O(g) ![]() 2CH3OH(g) △H2=+23.4kJ·mol-1
2CH3OH(g) △H2=+23.4kJ·mol-1
反应III:2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g) △H3
CH3OCH3(g)+3H2O(g) △H3
(1)△H3=_____________kJ·mol-1
(2)恒温恒容条件下,在密闭容器中通人等物质的量的CO2和H2,发生反应I。下列描述能说明反应I达到平衡状态的是_______(填序号)。
A.容器内的混合气体的密度保持不变B.反应体系总压强保持不变
C.CH3OH和CO2的浓度之比保持不变D.断裂3NA个H-O键同时断裂2NA个C=O键
(3)反应II在某温度下的平衡常数为0.25,此温度下,在密闭容器中加人等物质的量的 CH3OCH3(g)和H2O(g),反应到某时刻测得各组分浓度如下:
物质 | CH3OCH3(g) | H2O(g) | CH3OH(g) |
浓度/mol·L-1 | 1.6 | 1.6 | 0.8 |
此时![]() ___
___![]() (填“>”、“<”或“=”),当反应达到平衡状态时,混合气体中CH3OH 体积分数 V(CH3OH)%= _____%。
(填“>”、“<”或“=”),当反应达到平衡状态时,混合气体中CH3OH 体积分数 V(CH3OH)%= _____%。
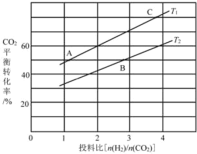
(4)在某压强下,反应III在不同温度、不同投料比时,CO2的平衡转化率如图所示。T1温度下,将6 mol CO2和12 mol H2充入3 L的密闭容器中,10 min后反应达到平衡状态,则0-10 min内的平均反应速率V(CH3OCH3)=____。
(5)恒压下将CO2和氏按体积比1 :3混合,在 不同催化剂作用下发生反应I和反应III,在相同的时间段内CH3OH的选择性和产率随温度的变化如下图。
其中:CH3OH的选择性=![]() ×100%
×100%
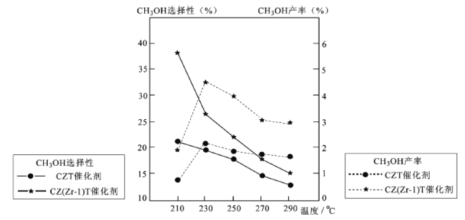
②在上述条件下合成甲醇的工业条件是_________。
A. 230℃ B. 210℃ C.催化剂 CZT D.催化剂 CZ(Zr-1)T
【题目】亚硝酰氯(NOCl,熔点:-64.5℃,沸点:-5.5℃)是一种黄色气体,遇水易反应,生成一种氯化物和两种常见的氮氧化物,其中一种呈红棕色。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如图所示:为制备纯净干燥的气体,下表中缺少的药品是:
制备原料 | 装置Ⅰ | 装置Ⅱ | |
烧瓶中 | 分液漏斗中 | ||
制备纯净Cl2 | MnO2 | ①__ | 饱和食盐水 |
制备纯净NO | Cu | 稀硝酸 | ②__ |
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:
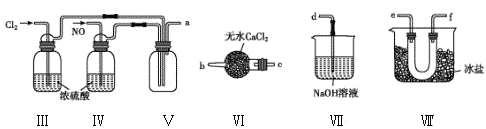
①装置连接顺序为a→____(按气流自左向右方向,用小写字母表示)。
②为了使气体充分反应,实验中先通入Cl2,待装置Ⅴ中充满黄绿色气体时,再将NO缓缓通入,此操作的目的是______(回答一条即可)。
③装置Ⅴ生成NOCl的化学方程式是________。
④装置Ⅵ的作用为___,若无该装置,Ⅷ中NOCl可能发生反应的化学方程式为__。
(3)丁组同学用以下方法测定亚硝酰氯(NOCl)纯度:
取Ⅷ中所得液体m克溶于水,配制成250mL溶液,取出25.00mL,以K2CrO4溶液为指示剂,用cmol/LAgNO3标准溶液滴定至终点,消耗标准溶液的体积为bmL。亚硝酰氯(NOCl)的质量分数为______(用代数式表示即可)。