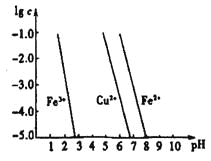
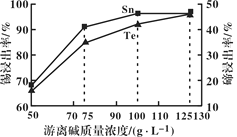
题目内容
【题目】甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0 kJ/mol
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ/mol
下列说法错误的是( )
A.CH3OH转变成H2的反应不一定要吸收能量
B.1mol CH3OH(g)完全燃烧放出的热量大于192.9 kJ
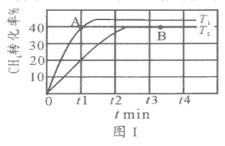
C.反应①中的能量变化如图所示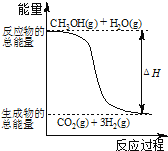
D.根据反应①和②推知:H2(g)+1/2O2(g)=H2O(g) ΔH=-241.9kJ/mol
【答案】C
【解析】
A. CH3OH转变成H2的过程按照反应①是吸热反应,按照②反应是放热反应,所以不一定要吸收能量,故A正确;
B. 反应②甲醇反应生成二氧化碳和氢气的焓变是-192.9kJ/mol;而1 mol CH3OH充分燃烧生成二氧化碳和水,氢气燃烧生成水也为放热反应,根据盖斯定律可知1mol CH3OH(g)完全燃烧放出的热量大于192.9 kJ,故B正确;
C. 反应①焓变大于零为吸热反应,图示为放热反应的能量变化,故C错误;
D. 根据盖斯定律,将②-①可得:H2(g)+![]() O2(g)=H2O(g)的△H=-241.9kJ/mol,故D正确;
O2(g)=H2O(g)的△H=-241.9kJ/mol,故D正确;
故答案为C。

【题目】汽车内燃机燃烧时,在高温引发氮气和氧气反应会产生 NOx 气体,NOx 的消除是科研人员研究的重要课题。
(1)通过资料查得 N2(g)+O2(g)2NO(g)△H反应温度不平衡常数的关系如下表:
反应温度/℃ | 1538 | 2404 |
平衡常数 |
|
|
则△H___________________0(填“<”“>”戒“=”)
(2)在 800℃时,测得 2NO(g)+O2(g) 2NO2(g)的反应速率不反应物浓度的关系如下表所示
初始浓度/ | 初始速率/ | |
C0(NO) | C0(O2) | |
0.01 | 0.01 |
|
0.01 | 0.02 |
|
0.03 | 0.02 |
|
已知反应速率公式为 V 正=K 正×c m(NO)cn(O2),则 m=___________________, K 正=___________________L2mol-2s-1
(3)在某温度下(恒温),向体积可变的容器中充人 NO2 气体,发生反应 2NO2(g) N2O4(g),气体分压随时间的变化关系如图
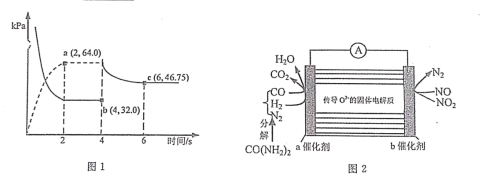
①该反应的压力平衡常数 KP=___________________。
②4s 时压缩活塞(活塞质量忽略不计)使容器体积变为原体积的 1/2,6s 时重新达到平衡,则P(N2O4)=___________________kPa。
(4)某学习小组利用图 2 装置探究向汽车尾气中喷入尿素溶液处理氮的氧化物。则该装置工作时,NO2 在 b 电极上的电极反应式为___________________。