题目内容
18.已知反应2HI(g)?H2(g)+I2(g)△H=+11kJ•mol-1,1molH2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)中化学键断裂时需吸收的能量(kJ)为( )| A. | 598 | B. | 576 | C. | 288 | D. | 299 |
分析 2HI(g)?H2(g)+I2(g)△H=+11kJ•mol-1的正反应为吸热反应,化学键断裂时需吸收的能量-化学键生成时需放出的能量=反应吸收的热量,据此进行计算.
解答 解:设1molHI(g)分子中化学键断裂时需吸收的能量为x kJ,
化学键断裂时需吸收的能量-化学键生成时需放出的能量=反应吸收的热量,
即:2x kJ-436kJ-151kJ=11kJ,
解得:x=299,
故选D.
点评 本题考查反应热的有关计算、键能与反应热的关系等,题目难度中等,明确“化学键断裂时需吸收的能量-化学键生成时需放出的能量=反应吸收的热量”解题的关键,注意反应热与键能的计算关系.

练习册系列答案
 53天天练系列答案
53天天练系列答案
相关题目
9.下列说法中,不正确的是( )
| A. | 与煤相比,天然气是较清洁的化石燃料 | |
| B. | 煤的干馏和石油的分馏都是物理变化 | |
| C. | 煤燃烧产生的硫氧化物和氮氧化物是形成酸雨的主要物质 | |
| D. | 苯可从煤焦油中提取,它是广泛应用的化工原料,有特殊气味,有毒 |
3.某有机物如图,下列说法错误的是( )
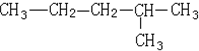
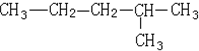
| A. | 该有机物属于饱和烷烃 | |
| B. | 该有机物可由两种单炔烃分别与氢气加成得到 | |
| C. | 该烃与2,3-二甲基丁烷互为同系物 | |
| D. | 该烃的一氯取代产物共有5种 |
10.某小组为研究原电池原理,设计如图装置.下列叙述正确的是( )


| A. | a和b不连接时,铁片上会有金属铜析出 | |
| B. | a和b用导线连接时,铁片上发生的反应为:Cu2++2e-═Cu | |
| C. | a和b用导线连接时,电子由a流向b | |
| D. | 无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色 |
7.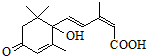 对盆栽鲜花施用S-诱抗素制剂,可以保证鲜花盛开.S-诱抗素的分子结构如图,下列关于该分子的说法正确的是( )
对盆栽鲜花施用S-诱抗素制剂,可以保证鲜花盛开.S-诱抗素的分子结构如图,下列关于该分子的说法正确的是( )
 对盆栽鲜花施用S-诱抗素制剂,可以保证鲜花盛开.S-诱抗素的分子结构如图,下列关于该分子的说法正确的是( )
对盆栽鲜花施用S-诱抗素制剂,可以保证鲜花盛开.S-诱抗素的分子结构如图,下列关于该分子的说法正确的是( )| A. | 含有碳碳双键、苯环、羟基、羰基 | |
| B. | 含有碳碳双键、羟基、羰基、羧基 | |
| C. | 1 mol该物质能与5 mol H2发生加成反应 | |
| D. | 与等物质的量的溴单质发生加成反应可得3种产物 |
8.生活中处处有化学,下列有关说法正确的是( )
| A. | 淀粉和纤维素均为天然高分子化合物 | |
| B. | 饮用矿泉水瓶的主要成分是聚氯乙烯 | |
| C. | 凡含有食品添加剂的食物均不可食用 | |
| D. | 大米煮成粥后,淀粉就变成了葡萄糖 |
 某温度下,在2L容器中X、Y、Z三种气体的物质的量(n)随着时间的(t)变化的曲线如图所示.由图中数据分写:
某温度下,在2L容器中X、Y、Z三种气体的物质的量(n)随着时间的(t)变化的曲线如图所示.由图中数据分写: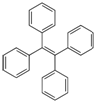 四苯基乙烯是一种在建筑及医疗设备、包装和电器制造中使用的化合物,结构如图.它的一氯代物有3种,分子中能共面的碳原子最多有26个.
四苯基乙烯是一种在建筑及医疗设备、包装和电器制造中使用的化合物,结构如图.它的一氯代物有3种,分子中能共面的碳原子最多有26个.