题目内容
【题目】在容积为1L的恒容密闭容器中,用三种纳米级Cu2O分别进行催化分解水的实验:2H2O(g)![]() 2H2(g)+O2(g) ΔH>0。水蒸气的浓度c随时间t的变化如下表所示:
2H2(g)+O2(g) ΔH>0。水蒸气的浓度c随时间t的变化如下表所示:
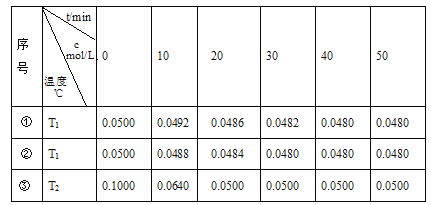
(1)对比实验的温度:T2_________T1(填“>”、“<”或“=”)
(2)催化剂催化效率:实验①________实验②(填“>”或“<”)
(3)在实验③达到平衡状态后,向该容器中通入水蒸气与氢气各0.1mol,则反应再次达到平衡时,请确定化学反应进行的方向_________________(填“向正反应反应进行”或“向逆反应方向进行”或“平衡不移动”)。
【答案】> < 平衡不移动
【解析】
①T1温度下达到平衡时,水蒸气的浓度为0.04800mol/L,根据方程式,H2的浓度为0.0020mol/L,O2的浓度为0.00100mol/L,所以平衡常数为![]() 。T2温度下达平衡时,同样可计算出平衡常数
。T2温度下达平衡时,同样可计算出平衡常数![]() ,大于T1温度下的平衡常数。水蒸气分解反应是吸热反应,升高温度,平衡正向移动,K变大,所以T2>T1。
,大于T1温度下的平衡常数。水蒸气分解反应是吸热反应,升高温度,平衡正向移动,K变大,所以T2>T1。
②实验①和②温度相同,起始加入的水蒸气的物质的量浓度也相同,到达平衡所需时间①>②,所以催化剂催化效率:实验①<实验②。
③实验③达到平衡状态时,水蒸气的浓度为再向该容器中通入水蒸气与氢气各0.1mol,![]() ,由于K=Q,所以平衡不移动。
,由于K=Q,所以平衡不移动。

练习册系列答案
相关题目