题目内容
【题目】把NaHCO3和Na2CO3·10H2O混合物6.56 g溶于水制成100 mL溶液,测得溶液中c(Na+)=0.5 mol/L。向该溶液中加入一定量盐酸恰好完全反应,然后将溶液蒸干,所得固体质量约为
A.2.93 g B.5.85 g C.6.56 g D.无法确定
【答案】A
【解析】
试题分析:钠离子的物质的量为0.05mol,向该溶液中加入一定量盐酸恰好完全反应,将溶液蒸干后,所得固体为氯化钠,且物质的量为0.05mol,由钠的守恒可知其质量为:0.5×0.1×58.5=2.93g。

 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案【题目】下表为元素周期表前三周期的一部分。
X | Z | ||
W | Y | R | |
(1)X的氢化物的沸点与W的氢化物比较,沸点较高的是:______________(填化学式),原因是_____________________。
(2)从下列选项中选出X的基态原子的最外层原子轨道表示式____________,另一原子轨道表示式不能作为基态原子的轨道表示式是因为它不符合____________。(填序号)。
A. 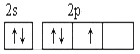 B.
B. 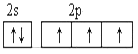
C.泡利原理 D.洪特规则
(3)以上W、Y、R元素原子失去核外第一个电子需要能量由多到少的顺序为:_______________(填元素符号)。
【题目】在2L密闭容器内,800℃时反应:2NO(g)+O2(g)![]() 2NO2(g)体系中,c(NO)随时间的变化如表:
2NO2(g)体系中,c(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)(mol/L) | 0.10 | 0.05 | 0.04 | 0.03 | 0.03 | 0.03 |
(1)分析上表,该反应达到平衡状态所需时间是_________。

(2)上图中表示NO2的浓度变化曲线是_______________。
(3)用NO表示从0~2s内该反应的平均速率v=________。
(4)v(NO):v(O2) = ______________。
(5)达到平衡状态时O2的转化率为________。
