题目内容
【题目】某学生设计了一个“黑笔红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。据此,下列叙述正确的是( )
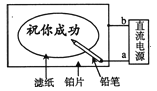
A. 铅笔芯作阳极,发生还原反应
B. 铂片端作阴极,发生氧化反应
C. 铅笔端附近有少量的氯气产生
D. 红字是H+放电,c(OH-)增大造成
【答案】D
【解析】此为电解氯化钠溶液的实验装置,电解时的阴极反应为:2H++2e-═H2↑或2H2O+2e-═H2↑+2OH-,阳极发生的反应为:2Cl--2e-═Cl2↑,总反应为:2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑,阴极溶液呈碱性,滴加酚酞溶液呈红色。A、用铅笔在滤纸上写字,会出现红色字迹,说明铅笔做阴极,反应为:2H++2e-═H2↑或2H2O+2e-═H2↑+2OH-,溶液呈碱性,滴加酚酞溶液呈红色,所以铅笔芯作阴极,发生还原反应,故A错误;B、阴极发生还原反应,阳极发生氧化反应,在该电解池中,铅笔做阴极,铂片做阳极,故B错误;C、铅笔做阴极,反应为:2H++2e-═H2↑,或2H2O+2e-═H2↑+2OH-,有氢气产生,故C错误;D、用铅笔在滤纸上写字,会出现红色字迹,说明铅笔做阴极,反应为:2H++2e-═H2↑或2H2O+2e-═H2↑+2OH-,溶液呈碱性,滴加酚酞溶液呈红色,故D正确;故选D。
2NaOH+Cl2↑+H2↑,阴极溶液呈碱性,滴加酚酞溶液呈红色。A、用铅笔在滤纸上写字,会出现红色字迹,说明铅笔做阴极,反应为:2H++2e-═H2↑或2H2O+2e-═H2↑+2OH-,溶液呈碱性,滴加酚酞溶液呈红色,所以铅笔芯作阴极,发生还原反应,故A错误;B、阴极发生还原反应,阳极发生氧化反应,在该电解池中,铅笔做阴极,铂片做阳极,故B错误;C、铅笔做阴极,反应为:2H++2e-═H2↑,或2H2O+2e-═H2↑+2OH-,有氢气产生,故C错误;D、用铅笔在滤纸上写字,会出现红色字迹,说明铅笔做阴极,反应为:2H++2e-═H2↑或2H2O+2e-═H2↑+2OH-,溶液呈碱性,滴加酚酞溶液呈红色,故D正确;故选D。

【题目】中华文化源远流长、博大精深。从化学的视角看,下列理解错误的是( )
A | B | C | D | |
中华 文化 | “千淘万漉虽辛苦,吹尽狂沙始到金”--刘禹锡《浪涛沙》 | 《天工开物》锤锻篇(冶铁)记载:“谚云,‘万器以钳为祖。’非无稽之说也。” | 成语“刀耕火耨(nòu)” |
侯德榜 |
从化学 的视角 理解 | 诗句中的“淘、漉”相当于分离提纯操作中的“过滤” | “钳”是指作为熔铁炉、加热炉的坩埚 | 古人播种前先伐去树木烧掉野草,用余灰可以肥田,还可以降低土壤碱性 | 我国化学工业的奠基人,主要成就: 侯氏制碱法,该碱指的是纯碱 |
A. A B. B C. C D. D