题目内容
【题目】铁及其化合物在生产生活及科学研究方面应用非常广泛。回答下列问题:
(1)Fe原子的核外电子排布式为_________。
(2)含锰奥氏体钢是一种特殊的铁合金,主要由Fe和Mn组成,其中锰能增加钢铁的强度和硬度,提高耐冲击性能和耐磨性能。第三电离能I3(Fe)____I3(Mn)(填“大于”或“小于”),原因___。
(3)工业电解熔融的FeO、Fe2O3冶炼高纯铁。FeO与Fe2O3相比,_____熔点高,其主要原因是_______。
(4)FeCl3可与KSCN溶液发生显色反应。SCN-的三种元素中电负性最大的是_______。
(5)液态环戊二烯中存在的微粒间相互作用有____
A 范德华力 B 氢键 C ![]() 键 D π键
键 D π键
环戊二烯分子中碳原子的杂化轨道类型是_____
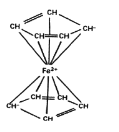
配合物中配体提供电子对的方式包括孤对电子、π电子等。二茂铁的分子结构如图所示,其中铁的配位数是____。
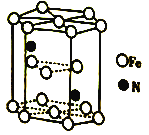
(6)Fe(CO)3与NH3在一定条件下可合成一种具有磁性的氮化铁。该磁性氮化铁的晶胞结构如图所示。六棱柱底边边长为acm,高为ccm,阿伏加德罗常数的值为NA,该磁性氮化铁的密度为____(列出计算式)g·cm-3。
【答案】[ Ar]3d64s2 (或) 1s22s22p63s23p63d64s2 小于 Mn2+的3d能级为半充满的相对稳定结构,较难失电子 Fe2O3 FeO与Fe2O3都是离子晶体,Fe3+的半径小且电荷大,Fe2O3晶格能大 N ACD sp2、sp3 6 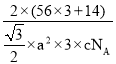
【解析】
(1)Fe为第26号元素,其原子核外有26个电子,根据构造原理书写该原子核外电子排布式;
(2)根据Fe2+的电子排布为[Ar]3d6,Mn2+的电子排布为[Ar]3d5,结合稳定结构分析判断;
(3)离子晶体晶格能越大,其熔沸点越高,晶格能与离子半径成反比、与电荷成正比;
(4)同周期从左到右,电负性逐渐增强,同主族从上到下,电负性逐渐减弱;
(5)环戊二烯的结构简式为![]() ,据此判断液态环戊二烯中存在的作用力;环戊二烯分子中存在两种碳原子,一种碳原子形成4个σ键,一种形成3个σ键,都没有孤电子对;根据二茂铁的分子结构,铁与4个π电子形成4个配位键,与2个孤对电子形成2个配位键,据此分析解答;
,据此判断液态环戊二烯中存在的作用力;环戊二烯分子中存在两种碳原子,一种碳原子形成4个σ键,一种形成3个σ键,都没有孤电子对;根据二茂铁的分子结构,铁与4个π电子形成4个配位键,与2个孤对电子形成2个配位键,据此分析解答;
(6)Fe原子位于结构单元的内部、顶点、面心,N原子位于内部,根据均摊法计算该晶胞中Fe原子和N原子个数,计算出晶胞的质量和体积,最后计算晶胞的密度。
:(1)Fe为第26号元素,根据电子排布规律,可知Fe的电子排布为1s22s22p63s23p63d64s2或[Ar]3d64s2,故答案为:1s22s22p63s23p63d64s2或[Ar]3d64s2;
(2)Fe的电子排布为[Ar]3d64s2,Mn的电子排布为[Ar]3d54s2,则Fe2+的电子排布为[Ar]3d6,Mn2+的电子排布为[Ar]3d5,Mn2+的3d能级为半充满的相对稳定结构,较难失电子,故第三电离能I3(Fe)<I3(Mn),故答案为:小于;Mn2+的3d能级为半充满的相对稳定结构,较难失电子;
(3)离子晶体晶格能越大,其熔沸点越高,晶格能与离子半径成反比、与电荷成正比,二者都是离子化合物,Fe3+的半径小且电荷多,Fe3+与O2-之间的离子键晶格能更大,故Fe2O3的熔点高于FeO的熔点,故答案为: Fe2O3;Fe2O3都是离子化合物,Fe3+的半径小且电荷多,Fe3+与O2-之间的晶格能更大;
(4)同周期从左到右,电负性逐渐增强,同主族从上到下,电负性逐渐减弱,而周期内变化比同族内变化要小得多,根据S、C、N三种元素位置关系可知,N元素电负性最大,故答案为:氮或N;
(5)环戊二烯的结构简式为![]() ,液态环戊二烯中存在极性键C-H和非极性键C-C、C=C,单键为σ键,双键中还含有π键,分子间存在范德华力;环戊二烯分子中存在两种碳原子,一种碳原子形成4个σ键,一种形成3个σ键,都没有孤电子对,分别采用sp3杂化和sp2杂化;配合物中配体提供电子对的方式包括孤对电子、π电子等,根据二茂铁的分子结构,铁与4个π电子形成4个配位键,与2个孤对电子形成2个配位键,铁的配位数为6,故答案为:ACD;sp2、sp3;6;
,液态环戊二烯中存在极性键C-H和非极性键C-C、C=C,单键为σ键,双键中还含有π键,分子间存在范德华力;环戊二烯分子中存在两种碳原子,一种碳原子形成4个σ键,一种形成3个σ键,都没有孤电子对,分别采用sp3杂化和sp2杂化;配合物中配体提供电子对的方式包括孤对电子、π电子等,根据二茂铁的分子结构,铁与4个π电子形成4个配位键,与2个孤对电子形成2个配位键,铁的配位数为6,故答案为:ACD;sp2、sp3;6;
(6)Fe原子位于结构单元的内部、顶点、面心,该晶胞中Fe原子个数=12×![]() +3+2×
+3+2×![]() =6,N原子个数为2,化学式为Fe3N,六棱柱底面积=a×a×sin60°×3cm2=
=6,N原子个数为2,化学式为Fe3N,六棱柱底面积=a×a×sin60°×3cm2=![]() a2×3cm2,晶胞体积=
a2×3cm2,晶胞体积=![]() a2×3×ccm3,氮化铁密度=
a2×3×ccm3,氮化铁密度=![]() =
= =
=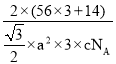 g/cm3,故答案为:
g/cm3,故答案为: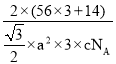 。
。

 名校课堂系列答案
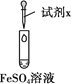
名校课堂系列答案【题目】某小组探究Br2、I2能否将Fe2+氧化,实验如下。
实验 | 试剂x | 现象及操作 |
| 溴水 | i.溶液呈黄色,取出少量滴加KSCN溶液,变红 |
碘水 | ii.溶液呈黄色,取出少量滴加KSCN溶液,未变红 |
(1)实验ⅰ中产生Fe3+ 的离子方程式是________。
(2)以上实验体现出氧化性关系:Br2_______I2(填“>”或“<”)。
(3)针对实验ⅱ中未检测到Fe3+,小组同学I2 +2Fe2+ ![]() 2Fe3+ + 2I-(反应a),限度小,产生的c(Fe3+)低;若向ⅱ的黄色溶液中加入AgNO3溶液,可产生黄色沉淀,平衡向_____移动,c(Fe3+)增大。
2Fe3+ + 2I-(反应a),限度小,产生的c(Fe3+)低;若向ⅱ的黄色溶液中加入AgNO3溶液,可产生黄色沉淀,平衡向_____移动,c(Fe3+)增大。
(4)针对小组同学的分析,进行实验ⅲ:向ⅱ的黄色溶液中滴加足量AgNO3溶液。现象及操作如下:
Ⅰ.立即产生黄色沉淀,一段时间后,又有黑色固体从溶液中析出;取出少量黑色固体,洗涤后,_________(填操作和现象),证明黑色固体含有Ag。
Ⅱ.静置,取上层溶液,用KSCN溶液检验,变红;用CCl4萃取,无明显现象。
(5)针对上述现象,小组同学提出不同观点并对之进行研究。
① 观点1:由产生黄色沉淀不能判断反应a的平衡正向移动,说明理由:______。经证实观点1合理。
② 观点2:Fe3+ 可能由Ag+ 氧化产生。
实验ⅳ:向FeSO4溶液滴加AgNO3溶液,_____(填现象、操作),观点2合理。
(6)观点1、2虽然合理,但加入AgNO3溶液能否使反应a的平衡移动,还需要进一步确认。设计实验:取ⅱ的黄色溶液,______(填操作、现象)。由此得出结论:不能充分说明(4)中产生Fe3+的原因是由反应a的平衡移动造成的。