题目内容
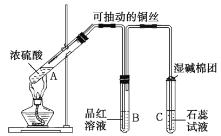
【题目】如图是![]() 与浓硫酸反应的实验装置。已知:铜片足量,浓硫酸(浓度为
与浓硫酸反应的实验装置。已知:铜片足量,浓硫酸(浓度为![]() )为
)为![]() 。下列有关判断正确的是( )
。下列有关判断正确的是( )
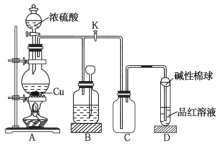
A.装置![]() 中盛装的是浓硫酸,作用是干燥
中盛装的是浓硫酸,作用是干燥![]()
B.装置![]() 为安全瓶,防止装置
为安全瓶,防止装置![]() 中的液体倒吸入装置
中的液体倒吸入装置![]() 中
中
C.品红溶液可检验生成的![]() ,碱性棉球的作用是吸收空气中的酸性气体
,碱性棉球的作用是吸收空气中的酸性气体
D.装置![]() 的作用是收集
的作用是收集![]()
【答案】D
【解析】
装置A为浓硫酸和铜加热制备SO2,装备B中有长颈漏斗,与外界大气相连,为安全瓶,如果发生堵塞,可以看到长颈漏斗导管中的液面上升,C为集气瓶,SO2密度大于空气,所以长管进气,D验证SO2的漂白性,碱性棉球的作用是吸收SO2防止其污染环境。
A.装置B为安全瓶,可观察反应过程中装置是否堵塞,A项错误;
B.装置C为集气瓶,用来收集![]() ,B项错误;
,B项错误;
C.碱性棉球的作用是吸收![]() ,防止其逸出,污染环境,C项错误。
,防止其逸出,污染环境,C项错误。
D.装置C为集气瓶,用来收集SO2,D项正确。
答案选D。

 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案【题目】在一固定容积的密闭容器中进行着如下反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其平衡常数K和温度t的关系:
CO(g)+H2O(g),其平衡常数K和温度t的关系:
t℃ | 700 | 800 | 850 | 1000 | 1200 |
K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
(1)K的表达式为:_________;
(2)该反应的正反应为_________反应(“吸热”或“放热”);
(3)下列选项中可作为该反应在850℃时已经达到化学平衡状态的标志的是:_________。
A.容器中压强不再变化 B.混合气体中CO浓度不再变化
C.混合气体的密度不再变化 D.c(CO2)=c(CO)=c(H2)=c(H2O)
(4)当温度为850℃,某时刻测得该温度下的密闭容器中各物质的物质的量见表:
CO | H2O | CO2 | H2 |
0.5mol | 8.5mol | 2.0mol | 2.0mol |
此时上述的反应中正、逆反应速率的关系式是_________(填代号)。
A.v(正)>v(逆) B.v(正)<v(逆) C.v(正)=v(逆) D.无法判断
(5)在700℃通过压缩体积增大气体压强,则该反应中H2(g)的转化率_________(“增大”、“减小”或“不变”);工业生产中,通过此方法使容器内气体压强增大以加快反应,却意外发现H2(g)的转化率也显著提高,请你从平衡原理解释其可能原因是__________________________________________。
Ⅱ.设在容积可变的密闭容器中充入10molN2(g)和10molH2(g),反应在一定条件下达到平衡时,NH3的体积分数为0.25。
(6)求该条件下反应N2(g)+3H2(g)![]() 2NH3(g)的平衡常数__________。(设该条件下,每1mol气体所占的体积为VL)上述反应的平衡时,再充入10mol的N2,根据计算,平衡应向什么方向移动?[需按格式写计算过程,否则答案对也不给分]__________。
2NH3(g)的平衡常数__________。(设该条件下,每1mol气体所占的体积为VL)上述反应的平衡时,再充入10mol的N2,根据计算,平衡应向什么方向移动?[需按格式写计算过程,否则答案对也不给分]__________。
【题目】下列实验中“实验内容”与对应“实验现象和结论”的关系都正确的是( )
选项 | 实验内容 | 实验现象和结论 |
A | 向FeCl3+3KSCN | 溶液的血红色变浅,说明增加生成物浓度,平衡逆移 |
B | 分别往甲:4mL0.1mol·L-1、乙:4mL0.2mol·L-1的酸性KMnO4溶液中加入2mL0.1mol·L-1H2C2O4溶液,记录褪色时间 | 乙先褪色,说明反应物浓度越大,反应速率越快,越先褪色 |
C | 室温下,5mL0.1mol·L-1Na2S2O3溶液中加入5mL0.1mol·L-1稀H2SO4溶液,观察现象 | 溶液立即出现浑浊,说明不可逆反应是瞬间完成的 |
D | 向饱和硼酸溶液中滴加0.1mol·L-1的Na2CO3溶液 | 无明显现象酸性:H3BO3<H2CO3 |
A.AB.BC.CD.D